(11分)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。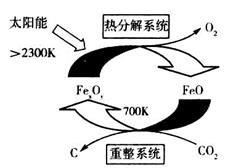
①若“重整系统”发生的反应中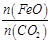 =6,则FexOy的化学式为______________。
=6,则FexOy的化学式为______________。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)=2CH3OH △H2=+23.4kJ·mol-1
则2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3= kJ·mol-1
CH3OCH3(g)+3H2O(g) △H3= kJ·mol-1
①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的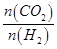 值变小
值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。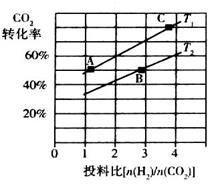
T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率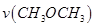 =____ __;KA、KB、KC三者之间的大小关系为______________。
=____ __;KA、KB、KC三者之间的大小关系为______________。
[化学选修-有机化学基础]乙酸丁香酚酯、肉桂酸乙酯都是常见的香料,它们的结构如下: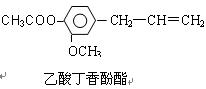

请回答下列问题:
(1)乙酸丁香酚酯的分子式是
(2)乙酸丁香酚酯在酸性条件下水解产物为M和乙酸,关于M的性质说法错误的是
a.易溶于水
b.遇FeCl3溶液显紫色
c.1mol M与浓溴水反应最多可消耗2molBr2
d.在一定条件下能发生加聚反应生成高分子化合物
e.能与NaHCO3溶液反应生成CO2气体
(3)肉桂酸乙酯含有的官能团名称是。
(4)已知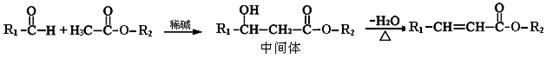
以下是肉桂酸乙酯的合成路线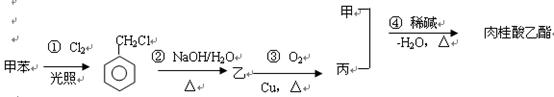 ①甲的名称是
①甲的名称是
②写出反应③的化学方程式其反应类型是
③肉桂酸乙酯的有多种同分异构体,写出符合下列要求的两个同分异构体的结构简式:
a.苯环上有3个取代基
b.苯环上的一氯代物仅有2种
c.1mol该物质与足量的银氨溶液反应得到4molAg
、。
[化学选修-物质结构与性质]已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)A的氢化物的分子空间构型是,其中心原子采取杂化,属于(填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元素 |
M |
F |
|
| 电离能 (kJ·mol-1) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是;
(4)晶体熔点:DCEC(填“<、=、>”),原因是。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因?
(6)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式
(写一个)。
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下: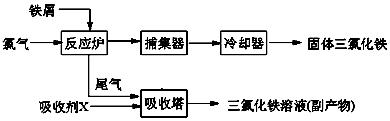
(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是:。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为:。
(4)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(5)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c mol/L Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:____________________________。
②样品中氯化铁的质量分数为: 。
③某同学根据上述方案,使用上述(2)中获得的FeCl3·6H2O样品代替无水氯化铁样品进行测定。通过计算发现产品中的质量分数大于100%,其原因可能是。
A、B、C、D、E、W均为短周期元素,原子序数依次增大。回答下列问题:
(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式:。
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)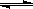 CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。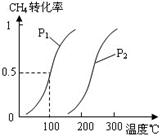
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的P1P2(填“<”、“>”或“=”),100℃时平衡常数为。
③在其它条件不变的情况下降低温度,逆反应速率将(填“增大”、“减小”或“不变”)。
(3)由A、C、D元素原子组成的化合物N2H4和H2O2 有广泛的用途。
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。电池放电时,负极的电极反应式为 。
②已知:16 g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75 KJ的热量。 H2O(1)=H2O(g)△H="+44" kJ·mol-1
2H2O2(1)=2H2O(1)+O2(g)△H=-196.4 kJ·mol-1
写出N2H4(肼)与氧气反应的热化学方程式为 。
四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O TiOCl2+2HCl↑)。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是实验室制备TiCl4的部分装置。
TiOCl2+2HCl↑)。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是实验室制备TiCl4的部分装置。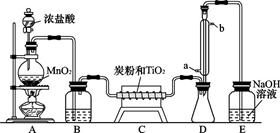
请回答:
(1)B装置中试剂为,其作用是(每空l分)。
(2)C装置中的反应方程式为。
(3)D装置中冷凝水的方向为进出,该装置的作用为。
(4)评价此装置的缺陷和不妥之处(每空2分):
| 编号 |
装置缺陷和不妥之处 |
| ① |
|
| ② |
|
| ③ |