室温下,在0.2 mol/LAl2(SO4)3溶液中,逐滴加入1.0 mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列说法正确的是
| A.a点,离子方程式为:Al3+ +3OH—→Al(OH)3↓ |
| B.a~b段,溶液pH增大,促进了氢氧化铝的碱式电离 |
| C.b~c段,加入的OH—主要用于生成Al(OH)3沉淀 |
| D.d点时,Al(OH)3沉淀开始溶解 |
有一处于平衡状态的反应:X(气)+3Y(气)===2Z(气)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是()
①高温②低温③高压④低压⑤加催化剂⑥除去Z
| A.①④⑥ | B.②③⑤ | C.①③⑥ | D.②③⑥ |
对于可逆反应:N2+3H2===2NH3,下列方法可以增加反应物分子中活化分子百分数的是()
| A.降低温度 | B.增大压强 | C.减少NH3 | D.使用催化剂 |
能确认发生了化学平衡移动的是()
| A.化学反应速率发生了变化 | B.物质的浓度发生了变化 |
| C.有气体参加的可逆反应达平衡后,对容器的压强增大 | |
| D.由于某一条件的改变,平衡混合物中各组分物质的浓度发生了不同程度的改变 |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的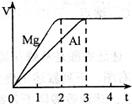
| A.物质的量之比为3∶2 | B.质量之比为3∶2 |
| C.摩尔质量之比为2∶3 | D.反应速率之比为2∶3 |
下列离子方程式与所述事实相符且正确的是()
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.用浓盐酸与反应制取少量氯气: MnO2+2H++2Cl- =Mn2++Cl2↑+2H2O |
| C.向NaAlO2溶液中通入过少量CO2制Al(OH)3:AlO2+CO2+2 H2O= Al(OH)3↓ |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3= FeO42-+3Cl-+H2O+4H+ |