在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应A(s)+3B(g) 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量
| A.①②③ | B.①④⑤ | C.①③⑤ | D.②③⑤ |
下列说法正确的是
| A.棉花和合成纤维的主要成分均为纤维素 |
| B.盐析可提纯蛋白质并能保持蛋白质的生理活性 |
| C.乙醇和苯都不能使溴的四氯化碳溶液和酸性KMnO4溶液褪色 |
| D.福尔马林可防腐,可用它保存海鲜产品 |
下列溶液中粒子的物质的量浓度关系正确的是
| A.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-) >c(OH-) |
| B.CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.已知在相同条件下酸性HF > CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-) > c(K+)-c(CH3COO-) |
对下列装置的叙述错误的是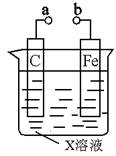
| A.X如果是硫酸铁,a和b分别连接直流电源正、负极,一段时间后向铁电极区滴入2滴黄色的K3[Fe(CN)6](铁氰化钾)溶液,有蓝色沉淀产生 |
| B.X如果是稀硫酸,则不论a和b是否用导线连接,铁片均发生氧化反应 |
| C.X如果是氢氧化钠,将碳电极改用铝电极,a和b用导线连接,此时构成原电池且铁作负极 |
| D.X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |
短周期元素X、Y、Z、M、N在元素周期表中的相对位置如下图,地壳中含量最高的元素已包含其中。
关于这些元素的叙述合理的是
| A.氢化物的稳定性M<Z |
| B.M与X形成的一种化合物可干燥YM2 |
| C.可用YN2洗涤试管壁上的N元素形成的单质 |
| D.在相同条件下Z元素形成的氢化物酸性强于N元素形成的氢化物酸性,说明非金属性Z>N |
下列关于元素及其化合物的说法正确的是
| A.将Na2O2投入NH4CI溶液中只能生成一种气体 |
| B.既能与酸反应;又能与碱反应的物质都是两性化合物 |
| C.常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道中某处是否泄漏 |
| D.CO2、NO2、SO2都能与H2O反应,其反应原理相同 |