下列关于元素及其化合物的说法正确的是
| A.将Na2O2投入NH4CI溶液中只能生成一种气体 |
| B.既能与酸反应;又能与碱反应的物质都是两性化合物 |
| C.常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道中某处是否泄漏 |
| D.CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
体积为1 L的某溶液中含有的离子如表所示:
| 离子 |
Cu2+ |
Al3+ |
NO3- |
Cl- |
 |
1 |
1 |
a |
1 |
用Pt电极电解该溶液,当电路中有3 mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是( )。
A.电解后溶液的pH=0
B.a=3
C.阳极生成1.5 mol Cl2
D.阴极析出的金属是铜与铝
下列说法正确的是( )。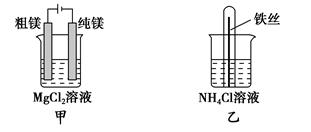
| A.用甲装置电解精炼镁 |
| B.用乙装置验证试管中铁丝发生析氢腐蚀 |
| C.用丙装置构成铜锌原电池 |
| D.用丁装置利用电冶金法制铝 |
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )。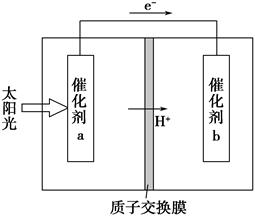
| A.该过程是将太阳能转化为化学能的过程 |
| B.催化剂a表面发生氧化反应,有O2产生 |
| C.催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| D.催化剂b表面的反应是CO2+2H++2e-=HCOOH |
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示。则下列说法正确的是 ( )。
| A.构成原电池时b极反应为Cu-2e-=Cu2+ |
| B.构成电解池时a极质量一定减少 |
| C.构成电解池时b极质量可能减少也可能增加 |
| D.构成的原电池或电解池工作后可能产生大量气体 |
下列有关电池的说法不正确的是( )。
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |