下列实验现象描述不正确的是
| 编码 |
实验 |
现象 |
| A |
加热放在坩埚中的小块钠 |
钠先融化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B |
在酒精灯上加热铝箔 |
铝箔融化,失去光泽,融化的铝并不滴落,好像一层膜兜着 |
| C |
在空气中久置的铝条放入NaOH溶液中 |
铝条立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| D |
在FeCl2溶液中滴入NaOH溶液 |
生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
把a L硫酸铵和硝酸铵的混合液分为两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与BaCl2溶液反应恰好消耗c mol BaCl2。则原溶液中NO3—的物质的量浓度是( )。
A. mol·L-1 mol·L-1 |
B.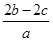 mol·L-1 mol·L-1 |
C.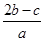 mol·L-1 mol·L-1 |
D. mol·L-1 mol·L-1 |
设NA为阿伏加德罗常数的值,下列说法正确的是( )。
| A.1 mol Al3+含有的核外电子数为3NA |
| B.1 mol Cl2与足量的铁反应,转移的电子数为3NA |
| C.室温下,10 L pH=1的硫酸溶液中含有的H+数为2NA |
| D.室温下,10 L pH=13的NaOH溶液中含有的OH-数为NA |
设NA为阿伏加德罗常数的值,下列叙述错误的是( )。
| A.标准状况下,22.4 L SO2和O2的混合气体中含有的氧原子数为2NA |
| B.标准状况下,22.4 L乙烯中含有共用电子对的数目为6NA |
| C.密闭容器中,3 mol H2和1 mol N2在高温、高压、催化剂的条件下充分反应后,容器内的气体分子总数为2NA |
| D.2.8 g的CO和2.8 g的N2所含质子数都为1.4NA |
设阿伏加德罗常数的数值为NA,则下列说法中正确的是( )。
| A.1.0 L 0.1 mol·L-1 Na2S溶液中含有的S2-离子数小于0.1NA |
| B.1 mol氯气与过量的Fe反应,转移电子的数目为3NA |
| C.2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| D.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
一定体积的溶质质量分数为14%的氢氧化钾溶液,若将其蒸发掉50 g水后,其溶质的质量分数恰好增大1倍,溶液体积变为62.5 mL。则浓缩后溶液的物质的量浓度为( )。
| A.2.2 mol·L-1 | B.4 mol·L-1 | C.5 mol·L-1 | D.6.25 mol·L-1 |