下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中,K+、Fe2+、I—、Br—可以大量共存 |
| B.用该溶液中溶解一定量铜粉,向所得溶液中再加入铁粉,若溶液中有Cu2+,则一定没有固体析出 |
| C.将该溶液蒸干,得到的固体中混有氢氧化铁 |
| D.100mL 0.1 mol/L该溶液和足量的Zn充分反应,生成1.12 gFe |
下列物质中有4种化学环境不同的氢的是
下列各组物质中,只用溴水就可以鉴别的是
| A.乙烯;乙炔;甲烷 | B.已烯;甲苯;己烷 |
| C.溴苯;苯;已烯 | D.溴苯;硝基苯;四氯化碳 |
下列有机反应中,能够实现的是
A.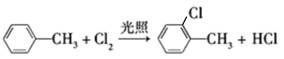 |
B. |
| C.ClCH2CH2CH3+NaOHH2O△CH3CH=CH2+NaCl+H2O |
D.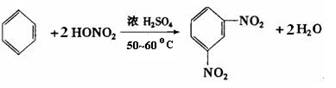 |
下列物质属于同系物的是
| A.CH3CH2CH2OH与CH3OH | B. |
| C.乙酸与HCOOCH3 | D.CH3CH2Cl与CH3CH2CH2Br |
下例说法不正确的是
| A.石油分馏产品不能使溴的四氯化碳溶液褪色 |
| B.裂解是为了获得气态烯烃等有机工业原料 |
| C.煤中含有苯及其同系物 |
| D.催化重整是获得芳香烃的主要途径 |