对物质进行分类是一种简单、有效的科学方法。下列各组物质的分类都正确的是
| A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质) |
| B.NO2(酸性氧化物)、CH3CHO(有机物)、CO(无机物)、CH3COOCH3(酯) |
| C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(氧化物)、CH3I(卤代烃) |
| D.液氨(氢化物)、NH4C1(铵盐)、HNO3(含氧酸)、冰水(混合物) |
下列图示的四种实验操作名称从左到右依次是
| A.过滤、蒸发、蒸馏、分液 | B.过滤、蒸馏、蒸发、分液 |
| C.蒸发、蒸馏、过滤、分液 | D.分液、蒸馏、蒸发、过滤 |
下列关于化学基本概念和基本理论的认识中正确的是
| A.一定温度、压强下,一定数量的任何物质的体积由微粒间的平均距离所决定 |
| B.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
| C.根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等。 |
| D.强电解质溶液的导电能力一定强于弱电解质溶液 |
下列说法均摘自某科普杂志,你认为无科学性错误的是
①铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒②碳酸钡可作X光透视肠胃的药剂③制铁:以铁矿石为原料,CO还原得铁④硅的提纯与应用,促进了半导体元件与集成芯电业的发展,可以说:“硅是信息技术革命的催化剂。”
| A.③④ | B.①③ | C.①④ | D.②③ |
把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中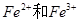 的物质的量浓度之比为1:2,则已反应的
的物质的量浓度之比为1:2,则已反应的 和未反应的
和未反应的 的物质的量之比为
的物质的量之比为
| A.1:1 | B.1::2 | C.1:3 | D.2:3 |
能在水溶液中大量共存的一组离子是
A.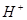 、 、 、 、 、 、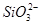 |
B.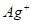 、 、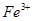 、 、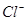 、 、 |
C.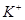 、 、 、 、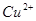 、 、 |
D.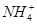 、 、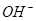 、 、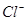 、 、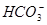 |