下列说法正确的是
| A.强电解质一定易溶于水 |
| B.常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸的水的电离程度小 |
| C.对可逆反应,升高温度一定存在v(正)>v(逆) |
| D.钢铁在海水中发生电化腐蚀时,铁是正极被氧化 |
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下气体的体积为(设反应中HNO3被还原成NO)()
| A.0.448L | B.0.672L | C.0.896L | D.0.224L |
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )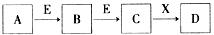
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法错误的是( )
A.若X为Cl2,则C可能为FeCl3
B.若X为KOH溶液,则A可能为AlCl3
C.若X为O2,则A可为硫化氢
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2。则原溶液中HBr和H2SO3的浓度都等于( )
| A.0.16mol/L | B.0.02mol/L | C.0.20mol/L | D.0.25mol•L‾1 |
下列物质与其用途完全符合的有()条
①Na2CO3—制玻璃;②SiO2—太阳能电池;③AgI—人工降雨;④NaCl—制纯碱
⑤Al2O3—焊接钢轨;⑥NaClO—消毒剂; ⑦Fe2O3—红色油漆或涂料;
⑧MgO—耐火材料
| A.4 | B.5 | C.6 | D.7 |