氨是重要的氮肥,合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。回答下列问题:在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ·mol-1。回答下列问题:在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图所示,回答下列问题: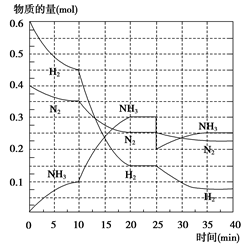
(1)10 min内 以NH3表示的平均反应速率为_________________________
(2)在10~20 min内, NH3浓度变化的原因可能是( )
| A.使用了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
(3)第1次平衡:平衡常数K1= ________________(带数据的表达式),第2次平衡时NH3的体积分数__________;
(4)在反应进行至25 min时,曲线发生变化的原因:______________________达第二次平衡时,新平衡的平衡常数K2______K1(填“大于”、“小于”或“等于”)。
现有m g某气体,它是由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数的数值用NA表示,则:
(1)该气体的物质的量为mol。
(2)该气体所含原子总数为个。
(3)若该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为。
(4)若该气体溶于1L水后所得溶液的密度为ρ g·cm-3,其物质的量浓度为mol/L。
取20ml 5mol/LNaOH溶液,加水稀释成100ml,所得溶液的物质的量浓度为;欲中和50ml稀释后的溶液,需2.5mol/LH2SO4溶液ml。
(1)用20g烧碱配制成500mL溶液,其物质的量浓度为mol/L;从中取出1mL,其物质的量浓度为mol/L;含溶质g;若将这1mL溶液用水稀释到100mL,所得溶液的物质的量浓度为mol/L,其中含Na+g。
(2)某气态氧化物化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为,R的相对原子质量为。
(1)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为,SO42-的物质的量浓度为。
(2)在标准状况下,4 g H2、11.2 L O2、1 mL H2O中,所含分子数最多的是,含原子数最多的是,质量最大的是,体积最小的是。
(3)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为,物质的量之比为,原子总数之比为,质量之比为 ,密度之比为 。
某原电池构造如下图所示。其电池的总反应是:Cu(s) + 2Ag+ (aq) = Cu2+ (aq) + 2Ag(s)。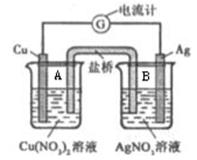
请回答以下问题:
(1)若盐桥为琼脂-KOH组成,其作用是___________________________。OH-离子移向_______(填“A”或“B”)中的溶液。Cu为原电池的______极,其电极反应式是_____________________________。A中的电解质溶液在该电池工作一段时间后会出现_______________________的现象。
(2)把盐桥改为铁棒后,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 (填“原电池”或“电解池”),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)(提示:当两个原电池串联时,电极材料的金属活动性相差较大的为原电池,电极材料的金属活动性相差较小的为电解池)。
(3)把盐桥改为铜棒后,电流计的指针 (填“会”、“不会”)发生偏转,左边烧杯中的硝酸铜浓度 (填“增大”、“减小”或“不变”)
(4)把盐桥改为银棒后,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。