燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。
(1)完成下列关于甲烷(CH4)燃料电池的填空:
①甲烷与氧气反应的化学方程式为:_________________
②已知燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-="=" CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
③随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
④通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
(2)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为____________________________
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变);
下图为某实验小组制取乙酸乙酯的实验装置图,烧瓶中盛有乙醇和浓H2SO4。反应时,将乙酸从分液漏斗滴入烧瓶中即可。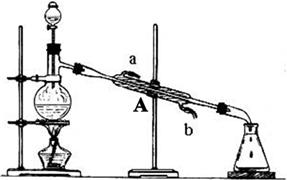
①为方便研究酯化反应的过程,乙醇中的氧原子用18O进行了标记(即C2H518OH),请用氧的同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式:。
②装置A的名称是,使用时要先从口(填“a”或“b”)进水。
③实验结束后,锥形瓶中收集到乙酸乙酯、乙醇和乙酸的混合液。为了将这三者进行分离,该小组依如下流程进行了进一步的实验: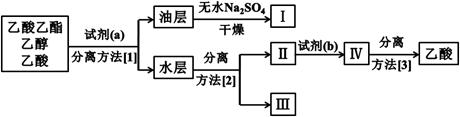
试剂(a)是,试剂(b)是,
分离方法(1)是,分离方法(2)是,分离方法(3)是。
食品添加剂必须严格按照食品安全国家标准(GB2760-2011)的规定使用。常作为食品添加剂中的防腐剂W,可以经过如下反应路线合成(部分反应条件略)。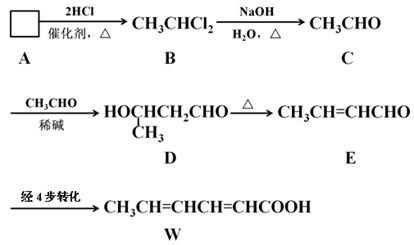
①已知A→B为加成反应,则A的结构简式为。请用化学方程式表示实验室制取A的原理:。
②用D的同分异构体D1制备 。
。
a、D1的结构简式为;
b、为避免副反应R-OH+R-OH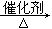 R-O-R+H2O的发生,合理的制备途径可以按照酯化、、的顺序依次进行(填反应类型)。
R-O-R+H2O的发生,合理的制备途径可以按照酯化、、的顺序依次进行(填反应类型)。
③已知乙烯不能被弱氧化剂氧化。依C→D→E的原理,由E制备W的4步转化为:
第1步:(用化学方程式表示);
第2步:消去反应;
第3步:(用化学方程式表示);
第4步:加适量稀酸酸化,提纯。
蛋白质是日常生活中人类必须的六大营养素之一,向两支盛有蛋白质溶液的试管中分别加入一定量的饱和硫酸铵溶液和硫酸铜溶液时都会出现沉淀,这两个作用过程被分别称为和,区别两种作用的简单方法是。
尿嘧啶(U)是核酸中的一种碱基。它由C、H、O、N四种元素组成,其球棍模型如右图所示。由此推断,尿嘧啶可能发生的反应有(填编号)。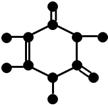
①水解②加聚③酯化④消去⑤银镜⑥还原
沉淀溶解平衡也有平衡常数,称为溶度积常数,符号为Ksp,对于某沉淀溶解平衡:
MmAn(s) mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。
(1)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(2)某温度时,在100g水中溶解0.74g Ca(OH)2达到饱和,此时溶液的体积约为100 mL,则该温度下Ca(OH)2的溶度积常数Ksp=。(写出计算过程)