下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
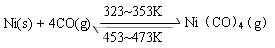
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
| A.纯Ni(s)和Ni(CO)4(g) | B.纯Ni(s)和CO(g) |
| C.不纯Ni(s)和CO(g) | D.不纯Ni(s)和Ni(CO)4(g) |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol· L-1的一元酸HA与b mol· L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是()
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,[H+]=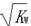 mol·L·-1 mol·L·-1 |
| D.混合溶液中,c(H+)+c(B+)===c(OH-)+c(A-) |
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=a+1的措施是()
| A.将溶液稀释到原体积的10倍 |
| B.加入适量的醋酸钠固体 |
| C.加入等体积0.2 mol·L-1盐酸 |
| D.提高溶液的温度 |
将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是()
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是()
| A.升高温度,X的体积分数减小 |
| B.增大压强(缩小容器体积),Z的浓度不变 |
| C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 |
| D.保持容器体积不变,充入一定量的Z,X的体积分数增大 |
制取水煤气的反应为C(s)+H2O(g) CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是()
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是()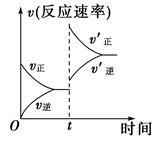
| A.加压 | B.升温 |
| C.增大水蒸气浓度 | D.增大碳的物质的量 |
一定条件下,可逆反应C(s)+CO2(g) 2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是()
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是()
| A.①②③④ | B.①③ | C.①② | D.①③④ |