利用氧化还原反应原理配平
NH3 + Cl2 N2 + NH4Cl
N2 + NH4Cl
在反应中 元素被氧化, 是还原产物。当反应中有0.3mol电子发生转移时,生成N2的体积(标准状况) L。
(12分)下图是元素周期表中的一部分。
在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。
请回答:
(1)硅的相对原子质量为 ;原子序数为8的元素位于元素周期表的第 周期,元素符号为 ,它属于 (填“金属”或“非金属”)元素。
(2)原子半径:钠 镁(填“>”或“=”或“<”,下同),原子得电子能力:硫 氯。
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质,且丁为黄绿色气体。气体B与气体C相遇产生大量的白烟,D是海水中浓度最高的盐(部分反应物和生成物及溶剂水已略去)。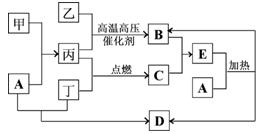
⑴甲的化学式是,C的化学式。
⑵写出A溶液和丁反应生成的离子方程式:。
⑶写出A和E反应的化学方程式:。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为: 。
(2)漂白粉的有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)。
用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③100 mL量筒;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50
mL量筒;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50 mL烧杯;应选用的仪器有(填编号)。
mL烧杯;应选用的仪器有(填编号)。
(2)应称取Na2CO3的质量为。
实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①取25mL甲溶液, 向其中缓慢滴入乙溶液15mL,共收集到112mL(标准状况)气体。
向其中缓慢滴入乙溶液15mL,共收集到112mL(标准状况)气体。
②取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到56mL(标准状况)气体。
(1)判断:甲是溶液,乙是溶液;(均填化 学式)
学式)
(2)②实验中所发生反应的离子方程式为:
;
(3)甲溶液的物质的量浓度为mol/L,乙溶液的物质的量浓度为mol/L