酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是
| A.R原子的电子层数比N的电子层数多1 |
| B.RO3-中R的化合价与NO3-中的N的化合价不相等 |
| C.RO3-和NO3-只能被还原,不能被氧化 |
| D.R和N元素的原子含有相同数目的未成对电子 |
英国物理学家约翰·丁达尔首先发现了入射光透过胶体时,从侧面可以看到一条光亮的通路。下列液体中,不会出现丁达尔效应的分散系的是 ( )。
①鸡蛋白溶液;②水;③淀粉溶液;④硫酸钠溶液;⑤沸水中滴入饱和FeCl3溶液;⑥肥皂水
| A.② | B.①③ | C.⑤⑥ | D.④ |
下列关于氧化物的叙述中正确的是 ( )。
| A.酸性氧化物均可与可溶性碱起反应 |
| B.酸性氧化物在常温下均为气态 |
| C.不能跟酸反应的氧化物一定能跟碱反应 |
| D.氧化物与水的反应都是化合反应 |
下列有关物质变化和分类的说法正确的是 ( )。
| A.电解熔融态的Al2O3、12C转化为14C都属于化学变化 |
| B.胆矾、冰水混合物、四氧化三铁都不是混合物 |
| C.葡萄糖溶液和淀粉溶液的本质区别是能否产生丁达尔效应 |
| D.SiO2、NO2、Al2O3都属于酸性氧化物 |
在标准状况下,用干燥烧瓶收集一瓶氯化氢气体倒置于盛水的水槽中时,水充满烧瓶(假设烧瓶里溶液不扩散出水槽),烧瓶里盐酸的密度为ρ g·cm-3。该盐酸的物质的量浓度、溶质的质量分数分别为( )。
A.c=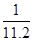 mol·L-1、w= mol·L-1、w=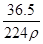 % % |
B.c=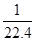 mol·L-1、w= mol·L-1、w=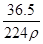 % % |
C.c=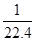 mol·L-1、w= mol·L-1、w=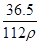 % % |
D.c=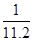 mol·L-1、w= mol·L-1、w=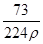 % % |
在溶液的配制过程中会引起浓度偏高的是 ( )。
①用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
④向80 mL水中加入18.4 mol·L-1硫酸20 mL,配制3.68 mol·L-1的硫酸溶液
⑤质量分数为5x%和x%的两种氨水等体积混合配制成3x%的氨水
| A.①③⑤ | B.②④⑤ | C.③④ | D.④⑤ |