某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省)如下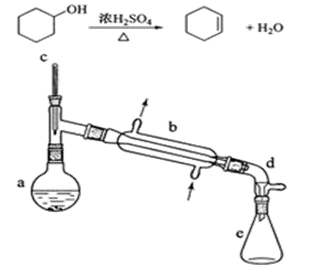
相关数据如下: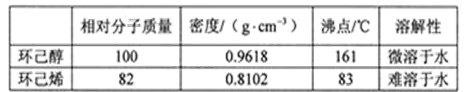
实验步骤:
1、[合成]:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入10mL浓硫酸。b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃。
2、[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2。再进行蒸馏最终获得12.30g纯环己烯。
回答下列问题:
(1)装置b的名称是_________________。加入沸石的目的是______________ 。
(2)本实验分液所得产物应从 _____________倒出(填“上口”或“下口”)。
(3)提纯过程中加入Na2CO3溶液的目的是_________________
加入无水CaCl2的作用是_________________________________。
(4)本实验所得环己烯的产率是______________________ (产率= ×100%)
×100%)
2Na2CO3·3H2O2是一种新型的氧系漂白剂。某实验兴趣小组进行了如下实验。
Ⅰ.实验制备
实验原理:2Na2CO3+3H2O2=2Na2CO3·3H2O2
实验步骤:取3.5 g Na2CO3溶于10 mL H2O,加入0.1 g稳定剂,用磁力搅拌器搅拌完全溶解后,将6.0 mL 30%H2O2在15 min内缓慢加入到三颈烧瓶中,实验装置如图。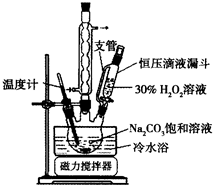
反应1小时后,加入1g氯化钠后,静置结晶,然后抽滤,干燥一周后,称重。
(1)装置中球形冷凝管的作用是______________。
(2)使用冷水浴的作用是______________________________________________。
(3)加入适量NaCl固体的原因是_______________________________________。
(4)2Na2CO3·3H2O2极易分解,其反应方程式可表示为_________________________________。
Ⅱ.活性氧含量测定
准确称取试样0.2000 g,置于250 mL锥形瓶中,加100 mL浓度为6%的硫酸溶液,用0.0200 mol/L高锰酸钾标准溶液滴定,记录高锰酸钾标准溶液消耗的体积为
32.70 mL。
活性氧含量计算公式:Q%=(40cV/m)×100%[c KMnO4标准溶液浓度(mol/L);V
KMnO4标准溶液浓度(mol/L);V 消耗的KMnO4标准溶液体积(L);m
消耗的KMnO4标准溶液体积(L);m 试样质量(g)]
试样质量(g)]
(5)滴定终点的判断依据为______________________________________________。
(6)滴定过程中涉及的化学方程式_______________________________________。
(7)活性氧含量为__________________________。
Ⅲ.产品纯度的测定
(8)为了测定产品中2Na2CO3·3H2O2的质量分数,设计了几种方案,涉及不同的反应原理。
方案一将试样与MnO2混合均匀,向混合物中滴加水,测生成气体的体积,进而进行计算。
方案二 _________________________________________________________________。
下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见表: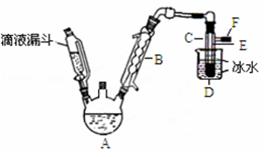
表.乙醇、溴乙烷、溴有关参数
| 乙醇 |
溴乙烷 |
溴 |
|
| 状态 |
无色液体 |
无色液体 |
深红棕色液体 |
| 密度/g•cm-3 |
0.79 |
1.44 |
3.1 |
| 沸点/℃ |
78.5 |
38.4 |
59 |
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是(选填序号)。
a.减少副产物烯和醚的生成
b.减少Br2的生成
c.减少HBr的挥发
d.水是反应的催化剂
(2)已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式。
(3)仪器B的名称,冷却水应从B的(填“上”或“下”)口流进。
(4)反应生成的溴乙烷应在中(填“A”或“C”中)。
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列(选填序号)溶液来洗涤产品。
a.氢氧化钠b.亚硫酸钠c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有。
辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2Mn2+:8.3~9.8Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要。
(2)酸浸时,为了提高浸取率可采取的措施有(任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:。
(4)调节浸出液pH=4的作用是。
(5)本工艺中可循环使用的物质是(写化学式)。
(6)获得的MnSO4•H2O晶体需要进一步洗涤、干燥,洗涤时应用洗涤。
(7)测定MnSO4•H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为。
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。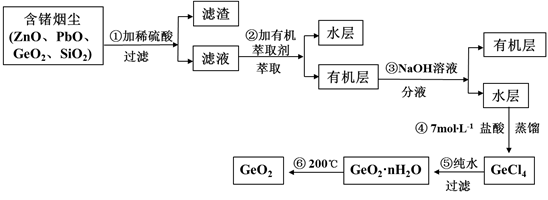
已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有(填化学式),实验室萃取操作用到的玻璃仪器有。
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如下图所示,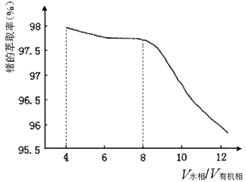
从生产成本角度考虑,较适宜的V水相/V有机相的值为。
(3)第④步加入盐酸作用(答两点即可)。
(4)第⑤步反应的化学方程式。
(5)检验GeO2·nH2O是否洗涤干净的操作是。
(6)GeO2产品中通常混有少量SiO2。取样品5.4g,测得其中氧原子的物质的量为0.105mol,则该样品中GeO2的物质的量为_____ mol。
(15分)日用牙膏的主要成分有:活性物质、摩擦剂、甘油等。假设牙膏中摩擦剂成分为CaCO3、SiO2、Al(OH)3中的一种或几种物质组成,牙膏中其他成分均可溶于益酸,且无气体产生。
(1)牙膏中添加甘油主要作用____。
为进一步探究牙膏中摩擦剂成分,进行了以下探究:
I摩擦剂成分的定性检验:设计实验方案,验证假设。请写出实验步骤以及预期现象和结论(可不填满也可补充)。可选的试剂:稀盐酸,稀硫酸,NaOH溶液,澄清石灰水
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 |
有难溶物存在 |
| 步骤2: |
①有无色气泡产生,说明有CaCO3; ②_________,说明有______。 |
| 步骤3: |
|
| …… |
II.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其主要作用。
(3)仪器C中选择Ba(OH)2而不选择Ca(OH)2溶液原因:①。②。
(4)下列各项措施中,能提高测定准确度的是____(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.缓慢滴加稀盐酸
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,洌得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为____。若改测定C中生成BaCO3质量为测定装置C在吸收CO2前后的质量差来确定CaCO3的质量分数,两方法测定的结果____(填“相同”或“不同”),原因是。