下图是实验室中制备气体或验证气体性质的装置图。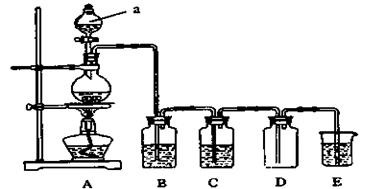
(1)仪器a的名称是_________________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为______________________________;
②装置B中溶液为________________,烧杯E中溶液的作用为____________。
(3)若利用图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。圆底烧瓶内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是_______________,现象是_______________;
②证明SO2具有还原性的现象是_____________________________________;
③D装置的作用是________________________________________。
④证明生成气体中含有CO2的现象是__________________________________;
(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下:
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。请写出A中发生反应的离子方程式:______________________________________________,
请写出试剂M为________溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是________________________________________________________________________。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为________________________________________________________________________。
(2)某废水中含有一定量的Na+、SO32—,可能含有CO32—,某研究小组欲测定其中SO32—的浓度,设计如下实验方案: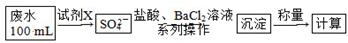
①从下列试剂中选择试剂X为________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO42—的离子方程式为_______________________________________
③证明该废水中是否含有CO32—的实验方案为_________________________________________________
某化学实验小组制备硫酸亚铁铵晶体并设计实验测定其组成,他们进行了以下实验。
Ⅰ.向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到一种浅蓝绿色的硫酸亚铁铵晶体,这种晶体俗名“摩尔盐”,它比绿矾稳定得多。将摩尔盐低温烘干后,称取7.84 g加热至100 ℃失去结晶水,质量变为5.68 g。
Ⅱ.选择图所示的部分装置连接起来,检查气密性后,将上述5.68 g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。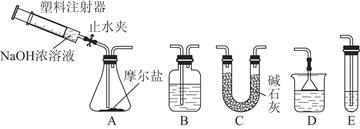
Ⅲ.向A中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。
根据上述实验回答下列问题:
(1)实验Ⅰ中,“一系列操作”依次为________、________和过滤,要检验FeSO4溶液中是否含有Fe3+常用的试剂是________。
(2)实验Ⅱ中,选择的装置是A接________接________(填代号),A装置中未使用分液漏斗的理由是____________________________________________________________
(3)向锥形瓶中加入NaOH溶液的操作方法是_________________________________________________________
吸收A中产生的气体所用试剂应是________;实验小组的同学为保证A中产生的气体被完全吸收,以准确测量其质量,他们在A中反应停止后再进行的操作是__________________________________________________________
(4)根据上述实验数据计算,此摩尔盐中,n(NH4+)∶n(Fe2+)∶n(SO42—)∶n(H2O)=____________。
阿司匹林(乙酰水杨酸,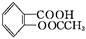 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
乙酸酐+水杨酸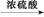

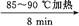
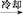
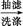 粗产品
粗产品
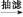
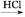
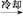
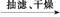 乙酰水杨酸
乙酰水杨酸
(阿司匹林) 测熔点
测熔点
主要试剂和产品的物理常数
| 名称 |
相对分子质量 |
熔点或沸点(℃) |
水 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
| 醋酸酐 |
102 |
139.4(沸点) |
反应 |
| 乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是。
(2)①合成阿司匹林时,最合适的加热方法是 。
②加热后冷却,未发现被冷却容器中有晶体析出,此时应采取的措施是 。
③抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(3)试剂A是 。
另一种改进的提纯方法如下:
粗产品
 乙酰水杨酸
乙酰水杨酸
(4)改进的提纯方法中加热回流的装置如图所示,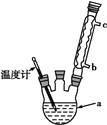
①使用温度计的目的是 。
②此种提纯方法中乙酸乙酯的作用是: ,所得产品的有机杂质要比原方案少,原因是 。
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。
请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
氯水中加入 NaHCO3粉末 |
有无色气泡产生 |
氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器)。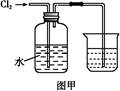
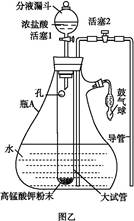
(1)氯水需临时配制的原因是 (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 。
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2 ,打开分液漏斗上口的玻璃塞,再打开活塞1 ,将少量浓盐酸注入大试管内。
②关闭活塞1 ,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A ,使氯气不断溶入水中。用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是 。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是 。
(4)配制氯水完成后,不必拆卸装置即可从瓶A 中取用少量氯水,方法是。