(15分)已知:①A从石油中获得是目前工业上生产的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平;② 。现以A为主要原料合成乙酸乙酯,合成路线如图。
。现以A为主要原料合成乙酸乙酯,合成路线如图。
(1)写出A的结构式__________________。
(2)B、D分子中的官能团名称分别是_____________、______________。
(3)写出下列反应的化学方程式:
①____________________________________;
②____________________________________;
④____________________________________;
(4)下列描述能说明反应④已达到化学平衡状态的有 。 ①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②正反应的速率与逆反应的速率相等
③ 单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
④混合物中各物质的浓度不再变化 ⑤单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
⑤单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
(5)反应④制得的乙酸乙酯粗产品中含有少量乙酸、乙醇和水,现拟分离乙酸乙酯、乙酸和乙醇,某小组设计了如下分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
试剂a是______________,试剂b是_________;分离方法①③分别是_______、________。
根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有___________种,金属性最强的元素与氧反应生成的化合物有___________ (填两种化合物的化学式)。
(2)属于稀有气体的是___________(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是___________。
(4)第三周期中,原子半径最大的是___________(稀有气体除外)。
(5)推测Si、N最简单氢化物的稳定性___________强于___________(填化学式)。
、
、
和
是周期表中前20号元素,已知:
①
的阳离子和
的阴离子具有相同的核外电子排布,且能形成组成为
的化合物;
②
和
属同族元素,它们能形成两种常见化合物;
③
和
属同一周期元素,它们能形成两种气态化合物;
④
和
能形成组成为
的化合物;
⑤
和
不在同一周期,它们能形成组成为
的化合物。
请回答:
(1)
元素是;
元素是。
(2)化合物
和
的化学式分别是和。
(3)
和
形成的两种常见化合物的分子式是和。
(4)写出
和
形成的一种气态化合物跟
反应的化学方程式:。
AB2离子化合物的阴、阳离子的电子层结构相同,1molAB2分子中含有54mol电子,且有下列反应:
①H2+B2 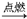 C
C
②B2+X→Y+AB2+H2O
③Y+C→AB2+Z,已知Z有漂白作用
(1)写出下列物质的化学式:
AB2,X,
Y,Z。
(2)写出反应②的化学方程式。
(3)写出反应③的离子方程式。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子的电子总数多4。1mol A的单质跟盐酸反应可置换出11.2L(标准状况)氢气,这时A转变为与氖原子具有相同电子层结构的离子。
试回答:
(1)A是元素,B是元素,C是元素。
(2)分别写出A、B最高价氧化物对应的水化物跟C的气态氢化物水溶液反应的离子方程式:。
(3)A离子的氧化性比B离子的氧化性(填“强”或“弱”),这是由于。
A、B、C、D四种短周期元素的原子序数依次增大。A、D同主族,B、C同周期。A、B组成的化合物甲为气态,其中A、B原子数之比为4∶1。由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子数之比为1∶1,丙中2∶1。由D、C组成的两种化合物丁和戊都为固态,丁中D、C原子数之比为1∶1,戊中为2∶1。
(1)写出化学式,甲______________,乙_____________,丙_____________,丁_____________,戊_____________。
(2)丁和戊可以分别与丙发生化学反应,请写出发生反应的离子方程式。
______________________________________________________________________________________________________________________________________________________________
(3)A、C两元素的单质可以与A、C、D三种元素形成的化合物的水溶液构成燃料电池,请写出电极反应式。
负极:_________________________________________________________________________;
正极:________________________________________________________________________。