A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水;D元素原子的次外层电子数比最外层电子数多4,E元素原子的最外层与最内层电子数的差是3。试回答下列问题:
(1)写出下列元素符号:A ,C ,D ,E 。
(2)用电子式表示B和F形成化合物的过程: 。
(3)写出A、C、F三种元素最高价氧化物对应的水化物相互反应的化学方程式:
、 、 。
现从固体KOH出发配制0.1mol/L 的KOH溶液 500mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
(2)如果在定容时仰视操作,则所配得溶液的浓度0.1mol/L(填> , =" ," <)
(3)若所用的固体KOH中混有NaOH,则所配得溶液的OH-浓度0.1mol/L(填> , =" ," <)
(4)若用250mL的H2SO4溶液恰好能将此500mL 0.1mol/L 的KOH溶液中和,则该硫酸的物质的量浓度为mol/L
在120℃、 1个大气压下,将150mL CH4和He的混合气体中与350mL O2混合,点燃并充分反应。
1个大气压下,将150mL CH4和He的混合气体中与350mL O2混合,点燃并充分反应。
(1)若恢复到原条件,则混合气体的总体积为mL
(2)若再将以上混合气体干燥,得混合气体450mL。则原混合气体中CH4和He的体积比为
下图各物质中,A、B、C是常见金属单质,甲、乙、丙是气体且乙是有特殊颜色的气体(图中有些反应的产物和反应的条件没有全部标出)。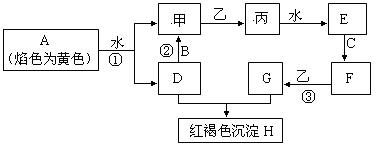
请根据以上信息回答下列问题:
(1)写出:H的化学式_________,乙的两种重要用途________________________________
(2)写出有关反应的离子方程式:
反应①__________________________________________________________
反应②__________________________________________________________
(3)判断反应③己经发生的常用试剂是______________________
(4)胶态磁流体(液溶胶)在医学上有重要用途,C单质对应元素的某种纳米级氧化物是磁流体中的重要粒子,该磁流体的主要制备过程如下:(Ⅰ)将NH3通入F、G的混合溶液(F、G物质的量比为1:2)中会生成两种碱。(Ⅱ)这两种碱恰好反应就得到该氧化物。写出(Ⅱ)中反应的化学方程式为:_________________________,确定该磁流体己成功制取的方法_________________________________
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40—50℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体:Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作(填氧化剂或还原剂)。
(2)写出CuH在氯气中燃烧的化学反应方程式
(3)CuH溶解在稀盐酸中生成的气体是(填化学式)
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)用方程式表示工业上用石灰石、氯气为原料生产漂白粉的原理_________________
_______________________________________________________,漂白粉的有效成分是(填化学式)
(2)漂白粉可用于饮用水或环境消毒,它溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,写出相应的化学方程式:___________________
(3)浓盐酸和次氯酸钙能发生下列反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,该反应中转移的电子数为___________
| A.①②③ | B.②③④ | C.②③ | D.①④ |