按要求回答下列问题:
(1)O4是意大利的一位科学家合成的一种新型氧分子,一个分子由四个氧原子构成,在相同条件下,等质量的O4和O3氧原子数之比为 ;两种气体的体积之比为 。
(2)已知下列几种物质①氨气②液氯③硫酸④盐酸⑤酒精⑥烧碱⑦氢氧化铁胶体,其中属于电解质的
是 (填写序号)。
(3)硅是太阳能电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意图如下:
物质A的化学式为 ;制备粗硅的反应为置换反应,且生成的气体具有还原性,该反应的化学方程式为 (提示:石英砂的主要成分是SiO2) 。
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有种不同的伸展方向,有种不同运动状态的电子。
(2)镓(
)与铝同族。写出镓的氯化物和氨水反应的化学方程式。
(3)硅与铝同周期。
是硅酸盐玻璃(
)的主要成分,
也可写成
。盛放
溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式
可推知钙长石的化学式为
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
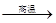 ↑
↑
常温下
的金属性比
的金属性(选填"强""弱")。利用上述方法可制取
的主要原因是。
a.高温时
的活泼性大于
b.高温有利于
分解
c.高温时
比
稳定 d.
的沸点比
的低
元素
位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素
基态原子的3p 轨道上有4个电子。元素
的原子最外层电子数是其内层的3倍。
(1)
与
所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,
离子的数目为。
②该化合物的化学式为。
(2)在
的氢化物(
)分子中,
原子轨道的杂化类型是。
(3)
的氢化物(
)在乙醇中的溶解度大于
,其原因是。
(4)
与
可形成
①
的空间构型为(用文字描述)。
②写出一种与
互为等电子体的分子的化学式:。
(5)
的氯化物与氨水反应可形成配合物
,1
该配合物中含有σ键的数目为。
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如
等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(
)可由
、焦炭和
在一定条件下反应获得。相关热化学方程式如下:
则
=
。
(2)白磷中毒后可用
溶液解毒,解毒原理可用下列化学方程式表示:
60
能氧化白磷的物质的量是。
(3)磷的重要化合物
、
和
可通过
与
溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与
的关系如图所示。
①为获得尽可能纯的
,
应控制在;
=8时,溶液中主要含磷物种浓度大小关系为。
②
溶液显碱性,若向溶液中加入足量的
溶液,溶液则显酸性,其原因是(用离子方程式表示)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体
,并释放出一种酸性气体。季戊四醇与
的核磁共振氢谱如下图所示。
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体
,并释放出一种酸性气体。季戊四醇与
的核磁共振氢谱如下图所示。
①酸性气体是(填化学式)。
②
的结构简式为
化合物A(分子式为 )是一种有机化工原料,在空气中易被氧化。
A 的有关转化反应如下(部分反应条件略去):
已知:①
②
(
表示烃基,
和
表示烃基或氢)
(1)写出
的结构简式:。
(2)
是常用指示剂酚酞。写出
中含氧官能团的名称:和。
(3)某化合物是
的同分异构体,且分子中只有两种不同化学环境的氢。写出该化合物的结构简式:
(任写一种)。
(4)
和
互为同分异构体。写出反应
→
的化学方程式:。
(5)根据已有知识并结合相关信息,写出以
和
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为
,含少量
)为原料制备高纯氧化镁的实验流程如下:
(1)
与稀硫酸反应的离子方程式为。
(2)加入
氧化时,发生反应的化学方程式为。
(3)滤渣2 的成分是(填化学式)。
(4)煅烧过程存在以下反应:
 ↑
↑
↑
↑
 ↑
↑
↑
↑
 ↑
↑
↑
↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
①
中收集的气体可以是(填化学式)。
②
中盛放的溶液可以是(填字母)。
a.
溶液 b.
溶液 c.稀硝酸 d.
溶液
③
中得到的淡黄色固体与热的
溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:。