现有家庭食用碱样品
(主要成分
,其它成分不与酸反应),向其中加入某未知浓度的盐酸,生成气体的质量与加入盐酸的质量关系如图.请计算:

(1)食用碱中碳酸钠的纯度是多少
(2)盐酸的溶质的质量分数是多少 (要求写出计算过程,结果精确到0.1)
生铁是铁的合金,化学兴趣小组的同学为测定某生铁样品中铁的质量分数.进行如下实验:称取生铁样品5.8
放入烧杯中,逐滴加入稀硫酸,所加稀硫酸的质量与放出气体的质量关系如图所示(生铁样品中的杂质不与稀硫酸反应,也不溶于水).回答下列问题: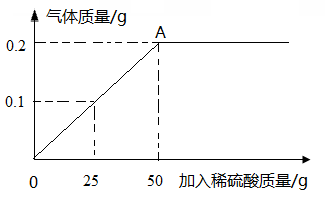
(1)当滴加稀硫酸质量为时,反应恰好完全,此时产生气体质量是.
(2)计算生铁样品中铁的质量分数(结果保留0.1
,下同).
(3)计算所用稀硫酸中溶质的质量分数.(温馨提示:
)
振衡中学校办工厂利用熟石灰与纯碱反应生产工业烧碱,学校化学兴趣小组到校办工厂检验刚生产出的一批产品的纯度(氢氧化钠的质量分数).检验时称取样品20.00g,溶于100.00g水中。向其中逐滴加入氢氧化钡
溶液,当恰好不再产生沉淀(
)时,用去溶质的质量分数为10.0%的氢氧化钡溶液8.55
,试求:
(1)反应中生成的碳酸钡的质量(保留2位小数)。
(2)该批产品中氢氧化钠的质量分数(精确到0.1% )。
(3)反应后所得溶液中氢氧化钠的质量分数(精确到0.1% )。
某钢铁厂用100 含氧化铁80%的赤铁矿炼铁,计算理论上可冶炼出铁的质量。
在某种细菌作用下,氨气(
)和氧气可处理含甲醇(
)的工业废水。
计算下列问题:
(1)
的相对分子质量为;
(2)
中氧气元素的质量分数(写出计算过程)。
某纯碱样品中含有少量氯化钠,取该样品11
,全部溶液在100
水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,
点时,过滤,得到滤液242
,计算: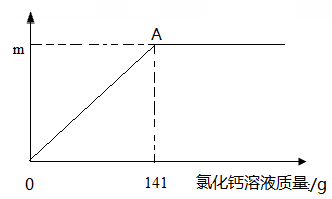
(1)反应生成沉淀的质量
为
。
(2)滤液中溶质的质量分数。