某碳酸钠样品中含少量氯化钠,化学兴趣小组的同学欲通过实验来测定样品中碳酸钠的质量分数。他们取5g该样品,配制成溶液,再向其中加入足量的氯化钙溶液(呈中性),测得加入氯化钙溶液的质量与产生沉淀的质量关系如图所示。请回答下列问题: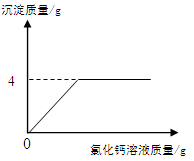
①该样品中碳酸钠的质量分数是多少?
(写出计算步骤,计算结果精确到0.1%)(7)
②如果反应开始前,向烧杯中滴加几滴无色酚酞试液,
在整个测定过程中可观察到的现象是:(8)。
下图是实验室制取氧气或二氧化碳时经常用到的装置,请回答有关问题。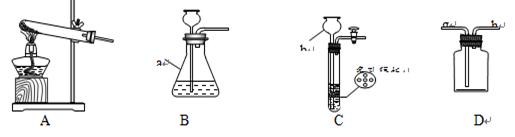
①写出仪器a、b的名称:a;b。
②装置C具有随时使反应发生或停止的特点,用该发生装置制取气体需满足的一般条件是。
③通过查阅资料得知:实验室用加热熟石灰和氯化铵的固体混合物制取氨气;氨气密度比空气小,极易溶于水,其水溶液显碱性。
(I)实验室制取氨气时选用的发生装置是(填编号),若用装置D收集氨气,进气口应为端(选填“g”或“h”)。
(II)若将收集满氨气的集气瓶倒扣在滴有无色酚酞试液的水中,观察到的现象是。
④实验室常用石灰石和稀盐酸制取CO2,某兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验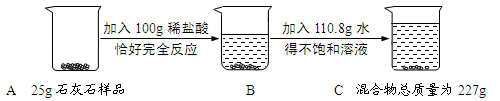
计算:(I)反应生成的二氧化碳的物质的量为mol。
(II)石灰石样品中碳酸钙的质量分数?(根据化学方程式列式计算)。
下面是实验室制取和收集气体的装置,根据所学知识回答下列问题: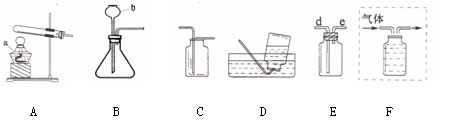
(1)写出仪器的名称:a;b
(2)从上图中选择装置制取并收集干燥的CO2,应选用图中的(填字母)。
(3)实验室若用装置E收集H2,气体应从导管的(填“d”或“e”)端进入。
(4)若制取的O2用B装置制取的反应原理,用F装置排水法收集,请将图F补画完整(直接在图中画出)。
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示。请完成下列计算内容:(写出计算过程)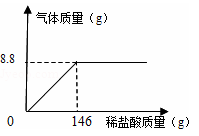
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?
欲测定某锌﹣铜合金中铜的质量分数,进行如下实验:取合金样品10克放入烧杯中,将60克稀硫酸分三次加入,充分反应后,测得生成气体的质量如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 加入稀硫酸质量/g |
20 |
20 |
20 |
| 生成气体质量/g |
0.08 |
m |
0.04 |
请回答下列问题并计算:
(1)第二次实验时生成气体质量m= _________ 克;
(2)计算该合金样品中铜的质量分数.
有氮气、一氧化碳和二氧化碳的混合气体80g,其中碳元素的质量分数为30%。使该混合气体通过足量的灼热氧化铁(Fe2O3)充分反应后,再将气体通入过量的澄清石灰水中,能得到白色沉淀的质量为( ) 克。