(8分)已知下表为25℃时某些弱酸的电离平衡常数;下图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化。
(1)图像中,曲线Ⅰ表示的酸是____(填化学式);起始时,c(CH3COOH)_____c(HClO)(填“>”、“<”、“=”)。
(2)a、b、c三点中,水的电离程度由大到小的顺序是___________(用编号表示)。
(3)25℃时,NaClO溶液的水解平衡常数Kh=_______________。
(4)向NaClO溶液中通入少量CO2的离子方程式为____________________。
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一。莽草酸 (A)的结构简式为: (提示:环丁烷
(提示:环丁烷 可简写成□)
可简写成□)
(1)A的分子式为___________
(2)A与溴的四氯化碳溶液反应的化学方程式为___________
(3)A与氢氧化钠溶液反应的化学方程式为___________
(4)17.4 g A与足量的碳酸氢钠溶液反应,则生成的二氧化碳的体积(标准状况)为________________
(5)A在浓硫酸作用下加热可得到B(B的结构简式为 ),其反应类型是___________
),其反应类型是___________
1mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A分子中必有一个___基,若此基在碳链的一端,则A的结构简式为。A与浓硫酸共热,分子内脱去1分子水,生成B,反应的方程式为;B通入溴水能发生________反应,反应的方程式为。
(10分)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
(1)烃A的分子式为________________
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则有______g烃A参加了反应。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为______
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为______(任写1个)
(5)比烃A少一个碳原子且能使溴水褪色的A的同系物有______种同分异构体.
写出下列反应的化学方程式。
(1)苯与液溴发生取代反应________________
(2)制乙酸乙酯的反应________________
(3)在苯酚钠溶液中通入过量的二氧化碳气体________________
(4)苯酚溶液与溴水的反应___________________________
燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g)△H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是_______________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。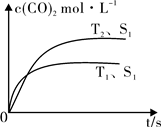
已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示: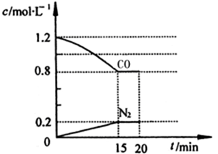
①有害气体NO的转化率为__________,0~15min NO的平均速率v(NO)=__________mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积b.增加CO的量
c.降低温度d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将______移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是_______(保留两位有效数字)。
(4)汽车尾气中的SO2和过氧化氢可设计成酸性原电池,请写出它的正极反应的方程式__________。