(9分)O3氧化海水中的I-是大气中碘的主要来源,将O3通入稀硫酸酸化的NaI溶液中进行模拟研究。
(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处。
| 编号 |
实验目的 |
反应物 |
反应前溶液的pH |
温度 |
| 1 |
对照组 |
O3+NaI+H2SO4 |
5.2 |
25℃ |
| 2 |
①__________ |
O3+NaI+H2SO4+FeCl2 |
5.2 |
②_____ |
| 3 |
探究温度对反应速率的影响 |
O3+NaI+H2SO4 |
③_______ |
5℃ |
(2)为测定生成I2的量,用移液管取20.00mL反应后溶液于锥形瓶中,用 c mol·L-1的Na2S2O3标准液滴定,消耗V mLNa2S2O3溶液。
已知:①H2S2O3是一种弱酸;②2Na2S2O3+ I2= Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是_____________;
②该实验中可选用_______(填物质名称)作指示剂。
③反应后溶液中碘的含量为_________ g·L-1。
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏_____(填“低”或“高”)。
(15分)某兴趣小组利用以下实验装置模拟工业炼铁的主要过程: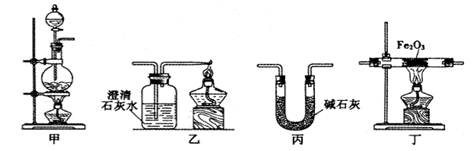
(1)装置甲中发生的反应为:HCOOH(甲酸) CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该(填字母)。
CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该(填字母)。
a.将甲酸滴入浓硫酸
b.将浓硫酸滴入甲酸
c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→()→()→()
(3)丙装置中碱石灰的作用是。
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为。
(5)为了探究影响反应产物的外界因素,在Fe2O3与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
| 加热方式 |
通CO加热 时间/min |
澄清石灰水变 浑浊时间/min |
产物颜色 |
产物能否全部被磁铁吸引 |
| 酒精灯 |
30 |
5 |
黑色 |
能 |
| 酒精喷灯 |
30 |
1 |
黑色 |
能 |
①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是、。
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:
i.全部为铁;
ii.;
iii.。
某化学兴趣小组用下图所示装置进行实验,探究硝酸与铁反应的产物。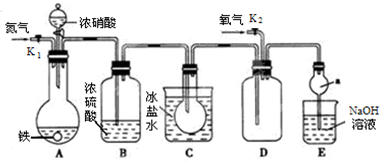
查阅资料得知:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
请回答下列问题:
(1)装置中各仪器装入试剂后,接下来由先至后的操作顺序为 。
| A.通入N2 | B.滴入浓HNO3 | C.打开活塞K1 | D.关闭活塞K1 |
(2)装置A中,滴入浓硝酸加热前没有明显现象的原因是。
(3)反应结束后,打开装置D中的活塞K2,并通入氧气,铁完全溶解于浓硝酸后生成的NO2气体中含有NO的现象为。
装置D中发生的反应的化学方程式为。
(4)C装置的作用是。
(5)反应停止后,装置A中无固体剩余。证明装置A的溶液中是否含有Fe2+,选择的药品是(填序号)。
a.铁粉b.氯水c.KMnO4溶液d.硫氰化钾溶液
(6)检验是否生成﹣3价氮的化合物,应进行的实验操作、现象及结论是。
(15分) 铝铁合金在微电机中有广泛应用,某兴趣小组为利用废弃的铝铁合金设计了如下实验流程制备聚合硫酸铁和明矾: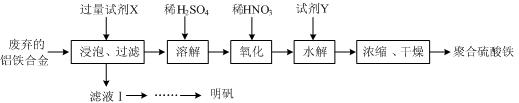
(1)聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①聚合硫酸铁可用于净水的原理是。
②有人认为上述流程中的“氧化”设计存在缺陷,请提出改进意见:;
浓缩时向其中加入一定量的乙醇,加入乙醇的目的是。
③加入试剂Y的目的是调节pH,所加试剂Y为;溶液的pH对[Fe2(OH)x(SO4)y]n中x的值有较大影响(如图1所示),试分析pH过小(pH<3)导致聚合硫酸铁中x的值减小的原因:。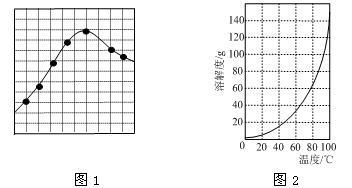
(2)明矾是一种常见铝钾硫酸盐。
①为充分利用原料,试剂X应为。
②请结合图2所示的明矾溶解度曲线,补充完整由滤液Ⅰ制备明矾晶体的实验步骤(可选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生,,得到明矾晶体。
(16分)甲、乙、丙三位同学在实验室用不同方法制取氮气。
(1)甲同学让空气通过右图所示装置,以除去氧气制得氮气。硬质玻璃管中所盛固体可选用(填下列选项标号)
A.铁粉B.碳粉C.过氧化钠D.碱石灰
(2)收集氮气可选用(填下列选项标号)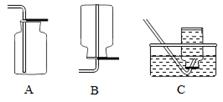
(3)乙同学设计用氨气和炽热的氧化铜反应制取氮气,反应方程式为。
(4)制取氨气可选用(填下列选项标号)
A.加热硫酸铵与氢氧化钙混合物
B.加热分解氯化铵晶体
C.浓氨水滴入氢氧化钠固体
D.加热浓氨水使氨气化
(5)丙同学用加热两种含氮溶液制氮气:NaNO2+NH4Cl  NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
该实验装置需要、分液漏斗、酒精灯等玻璃仪器。
(6)氮气助燃金属镁,反应方程式;燃烧3.6 g镁将消耗标准状况下氮气mL.
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已省略)。
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为___________________。
(2)装置B中饱和食盐水的作用是_______________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。
| a |
b |
c |
d |
|
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性大于溴。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_____________。
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式_________,判断改用NaHSO3溶液是否可行______(填“是”或“否”)。