已知一定条件下断裂或生成某些化学键的能量关系如下表:
| 断裂或生成的化学键 |
能量数据 |
| 断裂1mol H2分子中的化学键 |
吸收能量436 kJ |
| 断裂1mol I2分子中的化学键 |
吸收能量151 kJ |
| 形成1mol HI分子中的化学键 |
释放能量299 kJ |
对于反应:H2 + I2=2 HI,下列说法正确的是
A.该反应为放热反应
B.该反应中反应物总能量低于生成物总能量
C.HI分子中的化学键比H2分子中的化学键更牢固
D.无法判断
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.7.8 g Na2O2中含有的离子总数目为0.4NA |
| B.1mol 苯分子中含有碳碳双键数目为3NA |
| C.标准状况下,将分子总数为NA的NH3和HCl气体混合后的体积约为22. 4L |
| D.16g CH4与18 g NH4+ 所含电子数均为10NA |
下列各组离子可能大量共存的是
| A.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH、S2-、Br- |
| B.遇pH试纸变红色的溶液:Fe2+、S2O、SO42-、Na+ |
| C.水电离出的c(H+) •c(OH-) =10-28的溶液:Na+、S2-、NO3-、SO32- |
| D.能使KSCN显红色的溶液:Na+、NH4+、AlO、CO |
相对分子质量为128的有机物A完全燃烧只生成CO2和H2O,若A含一个六碳环且可与NaHCO3溶液反应,则其环上一溴代物的数目为
| A.1 | B.2 | C.3 | D.4 |
某课外实验小组设计的下列实验不合理的是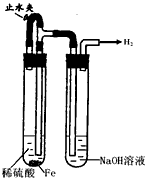
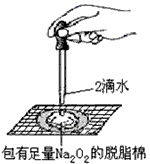
A装置①制备并观察氢氧化亚铁 B.装置②证明过氧化钠与水反应放热

C.装置③比较KMnO4、Cl2、 D.装置④测定盐酸的浓度
I2的氧化性强弱
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
| 待测气体 |
部分电极反应产物 |
| NO2 |
NO |
| Cl2 |
HCl |
| CO |
CO2 |
| H2S |
H2SO4 |
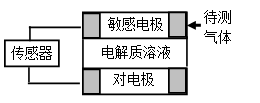
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同