设NA表示阿伏加德罗常数,下列叙述中不正确的是
| A.31g仅含有少量白磷,无其他杂质的红磷样品中,共含有NA个磷原子 |
| B.假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数小于NA |
| C.1molNa2O2与水反应转移的电子数为NA |
| D.58.5 g的氯化钠固体中含有NA个氯化钠分子 |
将足量CO2通入下列各溶液中,所含离子还能大量共存的是
| A.K+、SO32-、Cl-、NO3- |
| B.H+、NH4+、Al3+、SO42- |
| C.Na+、S2-、OH-、SO42- |
| D.Na+、C6H5O-、CH3COO-、HCO3- |
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量硫酸亚铁铵晶体放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有NH4+ |
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
| A.①②⑤ | B.③⑤⑥ | C.②④ | D.②④⑥ |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
用铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
溶液中无K+ |
| B |
向溶液中先滴加稀盐酸,再滴加BaCl2溶液 |
先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 |
溶液中一定含有SO42- |
| C |
向一定浓度的CuSO4溶液中通入适量H2S气体 |
出现黑色沉淀 |
H2S的酸性比H2SO4强 |
| D |
向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
下列物质转化在给定条件下能实现的是
①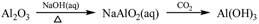
②
③
④
⑤
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |