以下有关物质的量浓度的叙述正确的是
| A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 |
| B.150 mL 1mol·L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol·L-1的氯化铝溶液中的c(Cl-)相等 |
C.20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0 mol·L-1,则此溶液中KCl的质量分数为 ×100% ×100% |
| D.20℃时,100 g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2% |
下列各组离子一定能大量共存的是
| A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B.在含有Al3+、Cl-的溶液中:HCO3-、I-、NH4+、Mg2+ |
| C.在c(H+)=1×10-13 mol·L-1的溶液中:Na+、S2-、SO2- 3、NO3- |
| D.在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl- |
下列说法正确的是
| A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B.使用催化剂可以改变化学反应的反应热 |
| C.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为氢氧化钠 |
D.反应2CO(g)=2C(s) + O2(g) ; 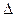 H>0可以自发进行 H>0可以自发进行 |
CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是
| A.Cs显+3价,I 、Cl 均显-1价 |
| B.Cs显 +1价,Cl显+1价,I显-1价、 |
C.在Cs ICl2溶液中通入Cl2 ,有单质碘生成 ICl2溶液中通入Cl2 ,有单质碘生成 |
| D.在CsICl2溶液中通入SO2气体,有硫酸生成 |
下列有关物质分类或归类正确的一组是
①液氨、液氯、干冰、碘化银均为化合物②氢氟酸、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、醋酸、次氯酸均为电解质④碘酒、牛奶、豆浆、漂粉精均为胶体
⑤Na2O2、Na2CO3、NaHCO3、Na2SiO3均为钠盐
| A.①和② | B.②和③ | C.③和④ | D.②③⑤ |
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
④根据反应的热效应将化学反应分为放热反应和吸热反应
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
| A.只有②④ | B.只有②③④ | C.只有①②④ | D.只有②③⑤ |