室温下,在0.2mol/L Al2(SO4)3溶液中,逐滴加入1.0mol/L NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3+ + 3OH-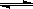 Al(OH)3 Al(OH)3 |
| B.a-b段,溶液pH增大,Al3+浓度不变 |
| C.b-c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D.d点时,Al(OH)3沉淀开始溶解 |
下列说法中不正确的是
| A.NaOH溶液和AlCl3溶液相互滴加的现象不同 |
| B.向淀粉碘化钾溶液中加溴水,溶液变为蓝色,说明Br2的氧化性强于I2 |
| C.氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |
| D.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明溶液中c(H+)>c(OH—) |
用NA表示阿伏加德罗常数的数值,下列说法中正确的是
| A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA |
| B.22.4L NH3中含有的原子总数为4NA |
| C.1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D.常温条件下,等物质的量浓度的HCl溶液和NaOH溶液混合,溶液pH=7 |
下列说法正确的是
| A.从海水提取物质都必须通过化学反应才能实现 |
| B.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| C.“绿色化学”的核心是利用化学原理进行环境治理 |
| D.生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且  的值与温度高低有关。当n(KOH)=a mol时,下列有关说法正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法正确的是
A.若某温度下,反应后  =11,则溶液中 =11,则溶液中  = = |
B.参加反应的被还原的氯气为 mol mol |
C.改变温度,反应中转移电子的物质的量ne的范围: mol≤ne≤ mol≤ne≤ mol mol |
D.改变温度,产物中KClO3的最大理论产量为 mol mol |
下列指定反应的离子方程式正确的是
| A.Cu溶于稀硝酸: Cu+2H++NO3- ==Cu2++NO2↑+H2O |
| B.在复盐NH4Fe(SO4)2溶液中加入一定量的Ba(OH)2溶液:2Fe3++3SO42-+3Ba2++6OH-==3BaSO4↓+2Fe(OH)3↓ |
| C.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+ ="=" CO2↑+3H2O |
| D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O ==Al(OH)3↓+HCO3- |