实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取盐酸体积_____mL ,所需要的仪器有___________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____________________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的______________________________,溶液注入容量瓶前需恢复到室温,这是因为___________________________________。
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)
a.没有进行A操作________ ;
b.加蒸馏水时不慎超过了刻度_______ ;
c.定容时俯视___________。
实验室欲配制6.0mol/L的H2SO4溶液,现有三种不同浓度的硫酸:
①480mL 0.5mol/L的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的浓硫酸.有三种规格的容量瓶:250mL、500mL、1000mL.配制要求:①②两种硫酸全部用完,不足的部分由③来补充.
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为________mol/L(保留1位小数).
(2)配制时的操作如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸________mL,沿玻璃棒缓缓倒入上述混合液中,并不断搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入________mL容量瓶中;
D._________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1cm~2cm处,改用胶头滴管滴加,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(3)容量瓶使用前需________,瓶上标有________、________、________
(4)进行操作C前还需注意__________________,否则会使所配溶液的浓度_______(填“偏大”、“偏小”或“无影响”).
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L氢氧化钠溶液在上图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题: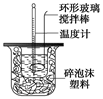
(1)环形玻璃搅拌棒的作用是 。
(2)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大”“偏小”或“不变”)。
(3)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
| 实验序号 |
起始温度t1/℃ |
终止温度t2/℃ |
温差(t2-t1)/℃ |
||
| 盐酸 |
NaOH溶液 |
平均值 |
|||
| 1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
| 2 |
25.1 |
25.1 |
25.1 |
30.6 |
5.5 |
| 3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容C=4.18×10-3 kJ/(g·℃),则该反应的中和热为ΔH=___________________。
(4)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会_______________(填“偏大”“偏小”或“不变”),其原因是___________。
(5)在中和热测定实验中测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热数值_______________(填“偏大”“偏小”或“不变”)。
(一)如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5 mL 盐酸于试管中.
试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式:
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片和盐酸的总能量。
(二)某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 的硫酸溶液进行中和热的测定,实验装置如图所示: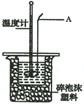
(1)仪器A的名称为 ;
(2)装置中碎泡沫塑料的作用是 ;
(3)写出该反应中和热的热化学方程式: (中和热为57.3 kJ·mol- 1) ;
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。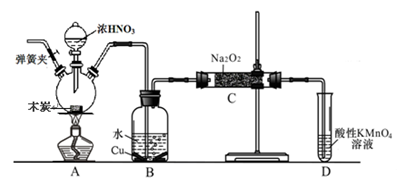
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O
②气体液化的温度:NO2:21℃、NO:-152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接):
(2)组装好仪器后,接下来进行的操作是 .
(3)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体中含有NO,依据的现象是___________________。
②装置B的作用是____________________,装置E的作用是______________
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是_________________________。