E~N等元素在周期表中的相对位置如下表。E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是
| A.K的氢化物水溶液显碱性 |
| B.F的单质与氧气反应只生成一种氧化物 |
| C.H与N的原子核外电子数相差14 |
| D.最高价氧化物的水化物酸性:K > L > M |
某溶液中可能含有 。某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化。下列说法正确的是
。某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化。下列说法正确的是
| A.溶液中一定存在Na+、I-、CO32- |
| B.溶液中一定不存在的只有I-、SO32- |
| C.只需再进行一个实验,就可完全确定溶液的组成 |
| D.溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种 |
特斯拉全电动汽车使用的是钴酸锂电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式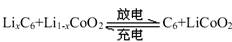 。下列说法不正确的是
。下列说法不正确的是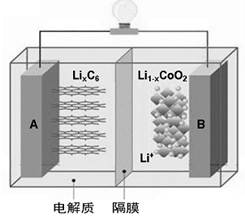
| A.放电时电子从A极通过导线流向B极 |
| B.放电时A是负极,电极反应式为:LixC6-xe-=C6+xLi+ |
| C.充电时Li+从左边流向右边 |
D.充电时B作阳极,电极反应式为: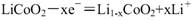 |
下列说法不正确的是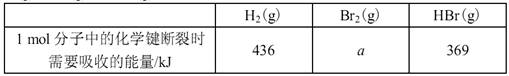
| A.若2H2(g)+O2(g)=2H2O(g) ΔH=―483.6 kJ·mol-1,则 H2燃烧热为-241.8 kJ·mol-1 |
| B.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
| C.H2(g)+Br2(g)=2HBr(g) ΔH=―72kJ·mol-1其它相关数据如上表:则表中a=230 |
| D.在隔绝空气下,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ 热量。则热化学方程式为Fe(s)+S(s)=FeS(s);ΔH=-95.6 kJ·mol-1 |
下列实验操作、现象和结论均正确的是选项 实验操作、现象、结论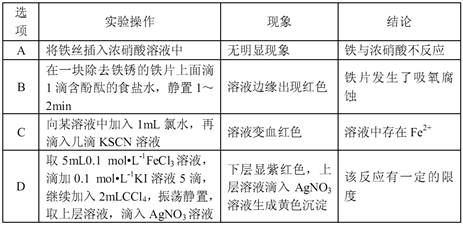
下列有关说法正确的是
| A.Na2CO3溶液中加入少量BaCl2晶体,CO32-水解程度减小,溶液的 pH 也减小 |
| B.SO2能与HClO 反应生成H2SO4,则可以说明HClO 酸性比H2SO4强 |
| C.向装有 Fe(NO3)2溶液的试管中加入稀 H2SO4,在试管口观察到红棕色气体,是因为HNO3分解产生了NO2 |
| D.反应NH3(g)+HCl(g)=NH4C1(s)在室温下可自发进行,则该反应的△H<0 |