常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
| A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L |
| B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L |
| D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L |
下列实验装置(固定装置略去)和操作正确的是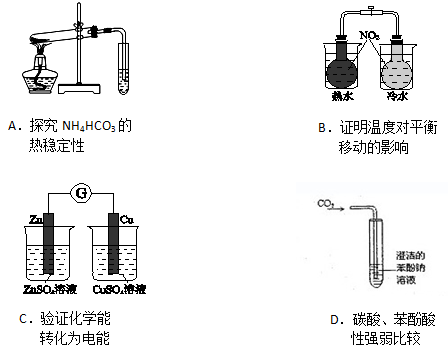
某学习小组为研究电化学原理,设计右图装置。下列叙述正确的是
| A.K与M、N均断开,一段时间后电解质溶液质量变大 |
| B.K分别与M、N相连时,铁均受到保护 |
| C.K与M相连时,每转移1mol电子Fe表面生成32gCu |
| D.K与N相连时,碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体 |
下图是温度和压强对X+Y 2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是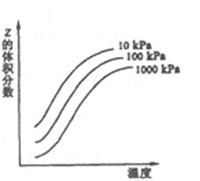
| A.X、Y、Z均为气态 |
| B.恒容时,混合气体的密度可作为此反应是否达到化学平衡[的判断依据 |
C.升高温度时 增大, 增大, 减小,平衡向右移动 减小,平衡向右移动 |
| D.使用催化剂Z的产率增加 |
能实现下列物质间直接转化的元素是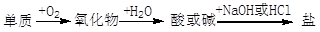
| A.硫 | B.硅 | C.铜 | D.铁 |
设NA代表阿佛加德罗常数,下列说法不正确的是
| A.1.5molNO2与足量的H2O反应,转移的电子数为NA |
| B.常温常压下,0.5NA个CO2分子质量为22g |
| C.28克氮气所含的原子数目为NA |
| D.在标准状况下,0.5NA个氯气分子所占体积是11.2L |