下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
D |
E |
|
G |
I |
| 3 |
B |
|
C |
|
F |
|
H |
|
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:______________。
熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
请回答下列问题:
(1)B极为_________极,发生_________(填“氧化”或“还原”)反应。
(2)电池总反应为___________________________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为g。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是(用化学方程式表示)
金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(2)一定温度下,氧化铁可以与一氧化碳发生如下反应: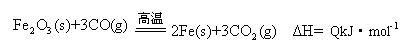
①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为;
②达平衡后,若温度升高,的值增大,则Q0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为(填序号)。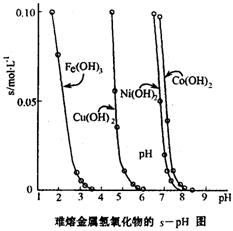
A.小于l B.4左右 C.大于6 D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=::。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是(填序号)。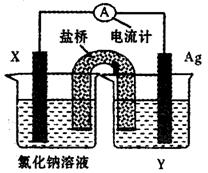
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
(Ⅰ)混合物的分离与提纯在化学实验中占有重要的位置。下图表示从固体混合物中分离X的方案,请回答有关问题。
(1)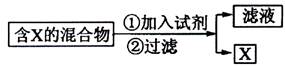
若按照以上图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是,有关反应的化学方程式为;
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作)。
(Ⅱ)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应: ,反应的氧化剂是______________,氧化产物为__________
,反应的氧化剂是______________,氧化产物为__________
(2)在精炼铜的过程中,电解液中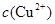 逐渐下降,
逐渐下降,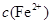 、
、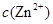 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的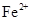 、
、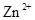 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
| 物质 |
 |
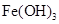 |
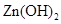 |
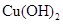 |
溶度积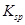 |
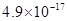 |
 |
 |
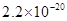 |
甲同学设计了如下除杂方案: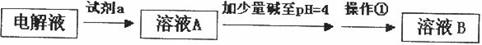
①试剂a是__________,其目的是____________________________________;根据溶度积该方案能够除去的杂质金属阳离子是____________。写出检验该杂质金属阳离子的操作方法:____________________________________________________________________________.
②乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7~8,可使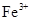 生成
生成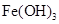 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也
应该将溶液pH调至7~8。你认为乙同学的建议是否正确?________(填“是”或“否”),
理由是________________________________________________________________________。
2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为,此时的温度为(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为。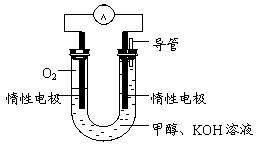
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
(Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)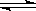 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下: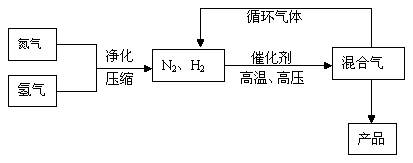
回答下列问题:
⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
则N2(g)+3H2(g) 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
Ⅱ:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa
时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ,写出表示N2H4燃烧热的热化学方程式是。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。肼—空气燃料电池放电时:
正极的电极反应式是。
负极的电极反应式。
(3)图是一个电化学过程示意图。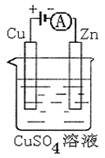
①锌片上发生的电极反应是。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气L(假设空气中氧气体积含量为20%)