能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为 。
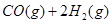

 ;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的
;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的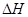 (填“<”“>”或“=”)0。
(填“<”“>”或“=”)0。
(2)利用工业废水中的CO2可制取甲醇,其反应为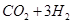

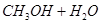 。
。
①已知下列反应的能量变化如图所示:
由二氧化碳和氢气制备甲醇的热化学方程式为 。
②为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示,从反应开始到平衡,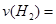 .
.
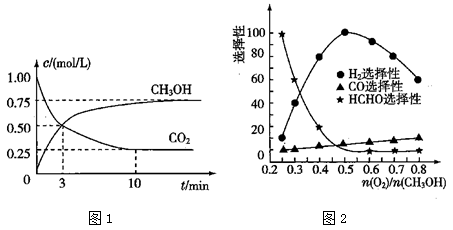
(3)工业上可利用甲醇部分氧化法制取氢气。在一定温度下以 为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制
为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制 = 。
= 。
(5分).利用右图所示装置收集以下6种气体
(图中烧瓶的位置不得变化):
①NO②Cl2③SO2 ④HCl ⑤NH3
⑴若烧瓶充满水,可收集的气体有,这时气体由口进入(填序号)
⑵若烧瓶是干燥的,则由A口进气,可收集的气体有。
⑶若在烧瓶中装入浓硫酸进行气体干燥,这时气体由口进入,则不可用此装置来干燥的气体有。
(10分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为:。
(4)比较Y、Z气态氢化物的稳定性>(用分子式表示)
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:>>>。
(6分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
| C |
N |
O |
F |
||
| Si |
P |
S |
Cl |
||
| Ge |
As |
Se |
Br |
||
| Sn |
Sb |
Te |
I |
||
| Pb |
Bi |
Po |
At |
(1)非金属性最强的元素是,常用来做半导体材料的元素是;
(2)形成化合物种类最多的元素是,写出该元素最高价氧化物的化学式;
(3)根据元素周期律,请你预测(填“>”或“<”):酸性强弱H3AsO4H3PO4,气态氢化物的稳定性AsH3H2Se 。
下列变化(填英文字母)
| A.碘的升华 | B.氯化钠溶于水 | C.氯化氢溶于水 | D.氯化铵受热分解。 |
(1)未发生化学键破坏的是;(2)仅发生离子键破坏的是__________ ;(3) 既发生离子键又发生共价键破坏的是____;
(8分)用化学方程式或电离方程式解释下列有关实验现象:
(1)取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有“白霜”。
(2)向氨水中滴几滴酚酞试液,溶液变红色:
(3)一瓶无色气体打开瓶盖后,瓶口呈现出红棕色: