分子式为CNH2NO2的羧酸和某醇酯化生成分子式为CN+2H2N+4O2的酯,反应所需羧酸和醇的质量比为1∶1,则该羧酸是
| A.甲酸 | B.乙酸 | C.丙酸 | D.乙二酸 |
下列关于物质结构的说法中正确的是()
| A.BF3、HClO分子中所有原子都满足最外层8电子结构 |
| B.水分子空间构型呈V形,氨分子呈三角锥形 |
| C.D2O分子与H2O分子是所含电子总数不相等的分子 |
| D.在任何物质分子中都含有化学键 |
关于离子键、共价键的各种叙述中,下列说法中正确的是()
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.非极性键只存在于双原子的单质分子(如Cl2)中 |
| C.在共价化合物分子内,一定不存在离子键 |
| D.由不同元素组成的多原子分子里,一定只存在极性键 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是
| A.电池工作时,锌失去电子,锌是负极 |
| B.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C.电池正极的电极反应式为:2MnO2+H2O+2e—==Mn2O3+2OH— |
| D.电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)  2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( ) 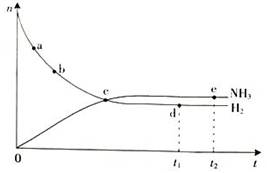
| A.点e的正反应速率比点d的大 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)相同 |
| D.在给定条件下,t1时刻NH3的含量达到最高 |
下列物质之间的相互关系不正确的是
A.O2和O3互为同素异形体B.
C.H、D、T互为同位素D.干冰和冰为不同一种物质