(1)下列关于工业生产说法正确的是 (填序号)。
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH |
Ca2+ 、Mg2+总浓度 |
细菌总数 |
| 6.5~8.5 |
< 0.004 5 mol·L-1 |
<100个·mL-1 |
以下是原水处理成自来水的工艺流程示意图: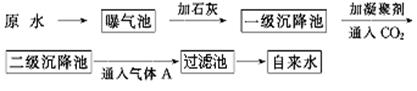
①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个): ; 。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 沉淀;通入二氧化碳的目的是 和 。
③气体A的作用是 ,通常可以用Ca(ClO)2替代A,下列物质中 同样可以作为气体A的代用品(填编号,多选倒扣)。
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2
现用Na2CO3固体配制500mL 0.200 mol•L-1的Na2CO3溶液。可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤漏斗;⑥天平;⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时不需要使用的有(填代号),还缺少的仪器是(填仪器名称)。
(2)经计算,需Na2CO3固体质量为。
(3)将所配制的Na2CO3溶液进行测定,发现浓度小于0.200 mol•L-1。请你分析配制过程中可能引起误差偏小的原因。
| A.定容时俯视液面 | B.转移时没有洗涤烧杯和玻璃棒 |
| C.配制时容量瓶没有干燥 | D.定容时仰视液面 |
有A、B、C、D、E、F、G、H等常见物质,已知有如下图转化关系,其中B、C 为常见非金属单质;F为常见金属单质;B在C中燃烧时,火焰呈苍白色;A和D的焰色反应为黄色。G和D溶液混和,产生红褐色沉淀。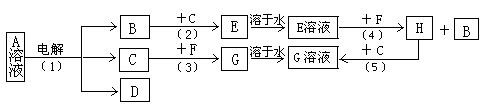
(1)反应(1)中若生成0.1mol B,则转移的电子的物质的量为。写出C与F反应的化学方程式。(注明反应条件)
(2)图中所示的5个反应中属于氧化还原反应的有:。(填写编号)
在 K2Cr2O7 + HCl ="==" KCl + CrCl3 + Cl2+ H2O反应中。
="==" KCl + CrCl3 + Cl2+ H2O反应中。
(1)元素被氧化,是氧化剂。
(2)是氧化产物,发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为。
(4)用双线桥标明电子转移的方向和数目并配平方程式。
有下列物质:①纯净的盐酸;②氯化钠晶体;③熔化的硫酸钠;④纯磷酸晶体;⑤氯气;⑥蔗糖;⑦三氧化硫;⑧钠;⑨氯水;⑩钾钠合金。按下列要求答题:
⑴能导电的物质有:;⑵属于电解质的有。
实验室配制480 mL 0.1 mol·L-1 NaOH溶液,回答下列问题。
(1)应用托盘天平称取氢氧化钠g。
(2)配制NaOH溶液时需用的主要仪器有托盘天平、钥匙、烧杯、玻璃棒、量筒、、。
(3)若实验时遇到下列情况,则所配制的物质的量浓度偏高、偏低还是不变。
①定容时俯视刻度线。②放在滤纸上称量NaOH固体。
(4)请你帮助把试剂瓶(盛放上述配制好的溶液)上标签的内容填上去(标签如下图