某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s)ΔH>0,下列叙述正确的是( )
Z(g)+W(s)ΔH>0,下列叙述正确的是( )
| A.加入少量W,逆反应速率增大 |
| B.升高温度,正反应速率增大,逆反应速率减小,平衡正向移动。 |
| C.当容器中气体压强不变时,反应达到平衡 |
| D.平衡后加入X,上述反应的ΔH增大 |
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
| A.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
| B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.达到化学平衡时,4v正(O2)=5v逆(NO) |
已知反应:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414kJ/mol ②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ/mol
下列说法正确的是 ( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物时,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.反应:Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol |
右图是某条件下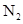 与
与 反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是()
反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是()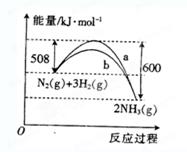
A.该反应的热化学方程式为 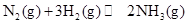 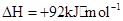 |
B.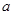 曲线是加入催化剂时的能量变化曲线 曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热数值会减小 |
D.反应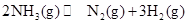 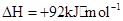 |
与实际化工生产流程相符的叙述是( )
| A.制备硝酸的工业中,理论上氨中的氮元素100%转化为了硝酸 |
| B.制备硫酸的工业尾气用氢氧化钠溶液吸收 |
| C.让Cl2在H2中燃烧制氯化氢,将氯化氢气体通入水中获得盐酸 |
| D.工业上用电解熔融氧化铝和冰晶石的混合物的方法得到铝 |