下列说法正确的是
| A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 |
| B.对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
| C.将铜片放入稀硫酸中,无现象。若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 |
| D.100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq) I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如下图所示(曲线上的任何一点都表示平衡状态)。
I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如下图所示(曲线上的任何一点都表示平衡状态)。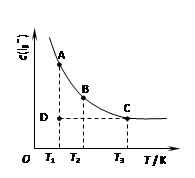
下列说法正确的是()
A.该反应的正反应为放热反应
B.A状态与C状态的化学反应速率大小为v(A)>v(C)
C.D状态时,v正>v逆
D.欲配制浓度较大的氯水,可将氯气通入氯化钾溶液中
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是()
| A.2Na2O2+2CO2→2Na2CO3+O2 |
| B.2Na2O2+2SO3→2Na2SO4+O2 |
| C.2Na2O2+H2SO4→Na2SO4+H2O2 |
| D.3Na2O2+Cr2O3→2Na2CrO4+Na2O |
为使溶液中的3种阳离子A+、B2+、C3+逐一沉淀分离,将含有A+、B2+、C3+离子的水溶液进行如下实验,关于三种离子的判断正确的是()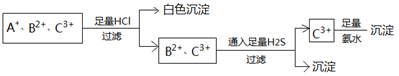
| A.Ag+、Fe2+、Al3+ |
| B.NH4+、Fe2+、Fe3+ |
| C.Ag+、Cu2+、Fe3+ |
| D.Ag+、Cu2+、Al3+ |
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见下图。下列说法正确的是()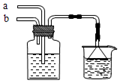
| A.a通入适量的CO2,b通入足量的NH3,纳米材料为Ca(HCO3)2 |
| B.a通入足量的NH3,b通入适量的CO2,纳米材料为Ca(HCO3)2 |
| C.a通入适量的CO2,b通入足量的NH3,纳米材料为CaCO3 |
| D.a通入少量的NH3,b通入足量的CO2,纳米材料为CaCO3 |
以下物理量只与温度有关的是()
| A.醋酸的电离度 | B.醋酸钠的水解程度 |
| C.水的离子积 | D.氨气的溶解度 |