下列解释实验事实的离子方程式正确的是
| A.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| B.漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
| C.酸性KI淀粉溶液久置后变蓝:4l-+O2+4H+=2I2+2H2O |
D.Na2S溶液使酚酞试液变红:S2-+2H2O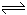 2OH-+H2S 2OH-+H2S |
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g) Z(g) ⊿H>0。经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g) ⊿H>0。经60s达到平衡,生成0.3mol Z。下列说法正确的是
| A.以Y浓度变化表示的反应速率为0.0005mol·L-1·s-1 |
| B.以X浓度变化表示的反应速率为0.0005mol·L-1·s-1 |
| C.若单位时间内生成a mol Y的同时,生成2a mol X,则反应达到平衡状态 |
| D.若升高温度,正反应速率增大,逆反应速率减小 |
CO、H2在一定条件下合成乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g),⊿H<0;下列说法错误的是
CH3CH2OH(g)+H2O(g),⊿H<0;下列说法错误的是
| A.反应物的总能量大于生成物的总能量 |
| B.使用合适的催化剂、升高温度均可加大反应速率 |
| C.增大H2浓度可以使CO全部反应 |
| D.反应达到平衡时,正反应和逆反应的化学反应速率相等且不为零 |
为检验试管中少量白色晶体是否为铵盐,下列四位同学分别设计了四种方案,其中最好的方案是
| A.加入1 mLNaOH溶液,将湿润的蓝色石蕊试纸靠近试管口 |
| B.加入1 mLNaOH溶液,将干燥的红色石蕊试纸靠近试管口 |
| C.加入1 mLNaOH溶液,加热试管,将干燥的蓝色石蕊试纸靠近试管口 |
| D.加入1 mLNaOH溶液,加热试管,将湿润的pH试纸靠近试管口 |
下列实验报告记录的实验现象正确的是
| 实验 |
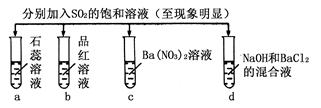 |
||||
| 记 录 |
a |
b |
c |
d |
|
| A |
无色 |
不褪色 |
无色溶液 |
无色溶液 |
|
| B |
红色 |
无色 |
白色沉淀 |
白色沉淀 |
|
| C |
红色 |
无色 |
无色溶液 |
白色沉淀 |
|
| D |
无色 |
无色 |
白色沉淀 |
无色溶液 |
以下说法正确的是
| A.白磷与金刚石一样,晶体中原子以共价键结合,形成空间网状结构 |
| B.CO2和SiO2晶体中,化学键类型相同,晶体类型也相同 |
| C.共价化合物可以含离子键 |
| D.NH4Cl晶体中既含有离子键又含有共价键 |