选做(15分)【选修3:物质结构与性质】
Ⅰ.Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物。请回答下列问题:
(1)基态Fe3+的电子排布式可表示为 。
(2)与CN-互为等电子体的分子有 (写出2种)。
(3)金属配合物Fe(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= 。
Ⅱ.已知氮化铝的晶胞结构如图所示。请回答下列问题: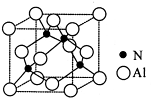
(4)下列说法正确的是__________(填序号)。
| A.氮化铝晶胞结构与NaCl相同 | B.第一电离能 N>Al |
| C.电负性N>Al | D.原子半径 N>Al |
(5)NH3空间构型为 ;已知(CH3)3Al为非极性分子,则其中铝原子的杂化方式为 。
(6)若氮化铝可由(CH3)3Al和NH3在一定条件下反应制得,则反应的方程式为 。
(7)若Al与N 原子最近的距离为a cm,则该晶体的密度为 g/cm。(阿伏加德罗常数用NA表示)
Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答: (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K/(mol·L-1)2 |
4.1×106 |
K1 |
K2 |
… |
完成下列问题:
①比较K1、K2的大小:K1K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是(填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-) 1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为 。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为:。
已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
______________________________________________________________________;
(2)从D溶液制备D的无水晶体的“操作a”为____________________________;
(3)E的电子式为_________________________________;
(4)反应⑤的化学方程式为_______________________________________________;
(5)原电池反应①中正极的电极反应式为___________________________________.
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: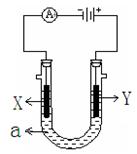
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。
在X极附近观察到的实验现象是。
② Y电极上的电极反应式为。
③总反应方程式:;
⑵若要在铁制品上镀一定厚度的银层
① X电极材料是(填铁或银);
② a是溶液
③ Y电极反应方程式:;
⑶若X、Y都是铂电极,电解某金属的氯化物(XCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g .
①该金属的相对原子质量是;②电路中有mol电子通过。
在某温度下,将H2和I2各0.10mol 的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=" 0.0080" mol·L-1
(1)该反应的平衡常数K= (填数值)。
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20 mol,达到化学平衡状态时:
C(H2)= mol ·L-1;c(HI)= mol·L-1。
(8分)完成下列方程式的书写(若有几种有机产物只写主要产物):
(1)丙烯与HBr反应:_________________________________________。
(2)1,3—丁二烯常温下与Br2等物质的量反应:______________________________。
(3)2—溴丁烷发生消去反应:___________________________________。
(4)甲苯与Cl2光照条件下等物质的量反应:___________________________________。