如图是制取溴苯的装置,试回答:
(1)装置A中发生有机反应的化学方程式是_ _。
(2)装置C中的现象是____ 。
(3)如果没有B装置,将A、C直接相连,你认为是否妥当? (填是或否)。
(4)实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:
①蒸镏②水洗③用于燥剂干燥④10%NaOH溶液洗⑤水洗正确的操作顺序是( )
A.①②③④⑤ B.④②③①⑤ C.②④⑤③① D.②④①⑤③
用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题: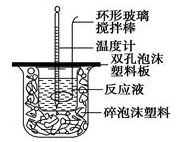
(1)烧杯间填满碎泡沫塑料的作用是 ;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替? (填“能”或“不能”),其原因是 ;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_______________。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量 (填“相等”“不相等”),若实验操作均正确,则所求中和热 (填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:___________________。
实验室配制500mL0.2mol/LNa2SO4溶液,实验操作步骤如下:
| A.用托盘天平上移出14.2g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温. |
| B.把制得的溶液小心地转移到容量瓶中. |
| C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切. |
| D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡. |
E.将容量瓶瓶塞塞紧,充分摇匀.
回答下列问题:
(1)操作步骤的正确顺序为(填序号)______________________;
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是_______。
(3)下列情况会使所配溶液浓度偏高的是(填序号)___________。
a.某同学观察液面的情况如图所示
b.没进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
实验室用NaOH固体配制500mL 1.2mol/L的NaOH溶液,请回答下列问题:
(1)需用托盘天平称取NaOH的质量 g。
(2)容量瓶上需标有以下五项中的 。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示)___________ __。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需NaOH的质量于烧杯中,加入少量水(约100mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与容量瓶刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G.检查容量瓶是否漏水
(4)下列操作会使所配制的溶液浓度偏低的是 (填字母)。
A.用称量纸称量NaOH固体
B.配制前容量瓶中有少量蒸馏水
C.溶液注入容量瓶前未冷却到室温
D.加蒸馏水定容时不慎超过了刻度线
E.定容时俯视刻度线
如下图所示,a、b均为活塞,可控制气体的通过和液体的加入,实验前活塞均已关闭(仪器的固定装置已省略)。请选择最适宜的试剂,利用下图,把一定量的CO2和CO混合气体中的CO2和CO分离。可供选择的试剂有:浓硫酸、稀硫酸、浓盐酸、稀盐酸、澄清的石灰水、氢氧化钠溶液、紫色石蕊试液。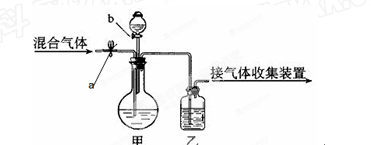
(1)甲装置的烧瓶中盛放的试剂是_____________,分液漏斗中盛放的试剂是__________;
(2)乙装置的瓶中盛放的试剂是_______________。
(3)打开活塞a时,分离出来的气体是__________________;要得到另一种气体时,正确的操作是__________________________。
ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应 2NaClO2+Cl2═2ClO2+2NaCl。如图1是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体。
(1)仪器P的名称是
(2)写出装置A中烧瓶内发生反应的化学方程式:
(3)E装置中所盛试剂的作用是
(4)F处应选用的收集装置是图2 (填序号),其中与E装置导管相连的导管口是图2 (填接口字母).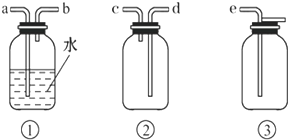
(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是如图3的
A.①② B.②③C.③④ D.②④
(6)若用100mL 2mol•L﹣1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是 (填序号).
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断.
(7)ClO2也可由NaClO3在H2SO4溶液存在下与Na2SO3反应制得.请写出反应的化学方程式: .