(每空2分,共10分)某同学学习过元素周期律、元素周期表后,为了探究同主族元素性质的递变规律,自己设计了一套实验方案,并记录了有关实验现象。现在请你帮助该同学完成实验报告。
Ⅰ.实验目的:探究同一主族元素性质的递变规律。
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳。
仪器:(1) ;(2) 。(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
| 序号 |
实验方案 |
实验现象 |
| ① |
将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 |
滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② |
将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 |
滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
Ⅳ.实验结论:(3)_________________________________。
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4) 。
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱。试列举一项事实说明F的非金属性比Cl强:(5) 。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
请回答该实验中的问题。
(1)写出该反应的化学方程式。
(2)实验前必须对整套装置进行的操作是。
(3)硬质玻璃管中石棉绒的主要作用是。
(4)干燥管中盛装的物质可以是
(5)点燃酒精灯和酒精喷灯的先后顺序是
实验室制NO及验证NO的性质,可以用如图所示的装置。请根据提示完成以下问题。已知反应:

1.NO的制备
(1)在加药品之前首先应进行的操作是(填操作名称),
(2)打开阀门K,取下活塞J向其中加入一小片铜片,装上活塞并推至底部。
(3)用注射器吸取适量的蒸馏水,然后倒立针筒,推动活塞J至底部以排尽装置内空气(装置内极少量的水不影响实验)。
(4)将注射器插入稀 中,吸取适量的稀
中,吸取适量的稀 ,然后迅速关闭阀门K,请回答此时可能观察到的实验现象:。
,然后迅速关闭阀门K,请回答此时可能观察到的实验现象:。
反应的离子方程式为:,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。
Ⅱ.NO性质实验
(1)观察注射器内气体呈色,然后打开K,吸取适量空气后关闭K,此时注射器内气体呈色,反应的化学方程式为:。
(2)向下快速推动活塞J,注射器内气体颜色变化情况为:,原因是
(结合化学方程式并配以必要的文字说明)。
(15分) Ⅰ、某同学用下图所示装置(尾气吸收装置未画出)向溶液Y中通入NH3和CO2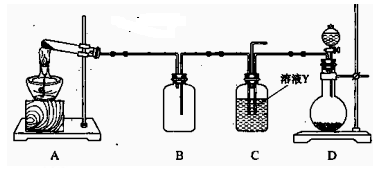
(1)下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2d.NaOH e.浓氨水
f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为(用药品序号填
空,下同);装置D处固体药品的最佳选择为(用药品序号填空)。
(2)下列各项制备实验中,也可利用装置D处仪器完成的是(填序号)。
| A.MnO2与浓盐酸反应制备Cl2 | B.Cu与浓硫酸反应生成SO2 |
| C.由H2O2分解制O2 | D.乙醇与乙酸反应制备乙酸乙酯 |
E.Zn与稀硫酸反应制备H2
(3)写出上述装置A处的试管中所发生反应的化学方程式:
。
Ⅱ、甲同学利用下图所示装置探究SO2和Cl2两种气体按不同比例混合后的漂白性。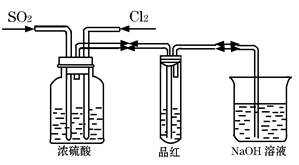
试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: (结合反应方程式)。
Ⅰ、下列说法不正确的是。
| A.用100mL的容量瓶准确量取100mL液体 |
| B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C.用托盘天平称量NaCl时,NaCl放在纸上; 称量NaOH时,NaOH放在小烧杯里 |
| D.用加热的方法提取NH4C1固体中的少量碘单质 |
E.浓硝酸与浓盐酸均易挥发,故都必须保存在棕色试剂瓶中,并置于阴凉处
Ⅱ、某同学在学习元素周期表后,将第二至第六周期的主族和零族元素排列成“八角星”元素周期表(如图),图中每个“·”代表一种元素,每个“八角星”代表一个周期,元素X核外有5个电子层。试写出M的元素符号是,元素Y的原子结构示意图为。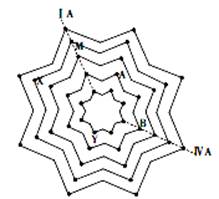
(16分)某化学兴趣小组欲设计使用如下装置验证:铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
试回答下列问题:
(1)将铜粉分散在石棉绒中的原因是________________________________;
(2)在铜和浓硝酸反应前,挤压打气球,经A、B、C反应后,进入D中的气体是___(填化学式),通入该气体的目的是____________________; 进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
(3)若C装置的硬质玻璃管中出现堵塞,则B中可能出现的现象是___________________;
(4)关闭k1、k2,打开k3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:_________;
(5)若E中出现倒吸,可采取的应急操作是_________________________;
(6)从E装置所得溶液中取出25.00mL,加两滴酚酞,用0.1000 mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,若实验测得F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应______ (填“有”或“无”)NO生成。