原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,E2+核外电子有18种运动状态,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| |
A |
B |
C |
D |
E |
F |
| 主要化合价 |
-1 |
-3 +5 |
-2 +6 |
-1 +7 |
+2 |
+1 +2 |
| 原子半径 |
0.071 |
0.11 |
0.102 |
0.099 |
0.197 |
0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)F2+与NH3 形成配离子的结构式为 ;该配离子具有对称的空间构型,其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则该配离子的空间构型为 。往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式 。
(3)A 、E两种元素形成晶体晶胞是下图中的 (填①、②、③或④);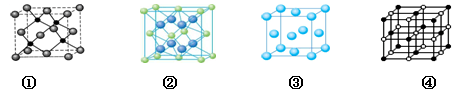
(4)下图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出A的氢化物所在的折线 (填n、m、x或y)。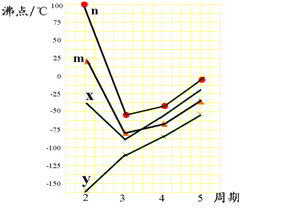
镧是重要的稀土元素,应用非常广泛,如应用于压电材料、催化剂等领域。
已知:①镧是较活泼金属,在空气中易被氧化;②氢氧化镧是难溶于水的弱碱;
③
| 金属 |
熔点(℃) |
沸点(℃) |
| 钙 |
841 |
1487 |
| 镧 |
920 |
3470 |
(1)操作1、3是相同操作,其名称是。
(2)操作2中要在HCl气体的氛围内加热的原因是。
(3)电解制镧的尾气要用碱液吸收,请写出反应的离子方程式。
(4)真空、高温过程中的反应方程式为。
(5)粗镧精制过程中温度控制范围。
(6)重熔蒸馏制得的镧中仍然混有及少量的钙。某批次产品69.709g,经分析含钙0.209g,该产品的等级为(化工产品等级标准:优级纯≥99.8﹪,分析纯≥99.7﹪,化学纯≥99.5﹪).
X、Y、Z、W是常见的四种短周期元素,其原子序数依次增大。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子最外层电子排布式为nsnnpn |
| Y |
Y是空气中含量最高的元素 |
| Z |
Z是地壳中含量最高的金属元素 |
| W |
W的单质是常见的半导体材料 |
(1)Y位于元素周期表的 周期 族,Y与W的气态氢化物较稳定的是(写化学式)
(2)Z的单质与W的单质相比熔点较高的是(写化学式);Z与W原子半径较大的是 (写化学式)
(3)X的一种氧化物XO2分子中σ键与∏键数目之比为
(4)X的第一电离能比W的(填“大”或“小”)
(5)写出X的单质与Y的最高价氧化物水化物的浓溶液在加热的条件下反应的化学方程式:
(6)已知2.7gZ单质与足量Y单质反应,放出31.8kJ的热量,请写出此反应的热化学方程式:。
锗及其某些化合物是导弹火箭制导中的重要光电材料,工业上生产锗的流程如下: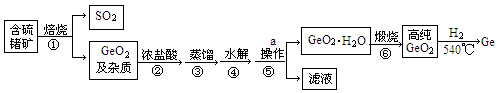
已知:GeO2与浓盐酸反应生成四氯化锗(熔点为—51.5℃,沸点为86.6℃)。四氯化锗易水解。
(1)步骤②中浓盐酸除了作为反应物外,还有一个重要作用是。
(2)步骤③控制的温度范围。
(3)写出反应的④、⑥的化学方程式
④;⑥。
(4)生产过程中可以循环利用的物质是(填化学式)
(5)步骤①中产生的SO2可以用碱液吸收,请写出离子反应方程式。
(6)请简要描述实验室中操作a的过程。
Favorskii反应是化工生产中的重要反应,它是利用炔烃与羰基化合物在强碱性下发生反应,得到炔醇,反应原理为: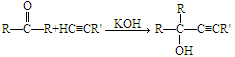
已知:
以下合成路线是某化工厂生产流程的一部分:
请回答下列问题:
(1)写出F中官能团的名称。
(2)写出D的名称(系统命名)。
(3)④的反应类型是;B的结构简式是。
(4)写出反应⑥的化学方程式为。
(5)H是D的同分异构体,核磁共振氢谱有3种峰且属于炔烃的结构简式为
、。
(6)有关C的说法正确的是
| A.能使溴的四氯化碳溶液褪色 | B.能和氢氧化钠溶液反应 |
| C.能使酸性高锰酸钾褪色 | D.能与乙酸发生酯化反应 |
X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的一种核素的质量数为18,中子数为10 |
| Y |
Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一 |
| Z |
Z的单质常温下为黄绿色气体 |
| W |
W的基态原子核外有4个未成对电子 |
(1)Z位于元素周期表的位置,写出Z的原子结构示意图。
(2)Y的电负性比Z 的(填“大“或”小”);X和Y的气态氢化物中,较稳定的是(写化学式)。
(3)X的一种氢化物H2X2分子中极性键和非极性健数目之比为。
(4)Z的一种单质与烧碱溶液作用可以生产日常生活用的消毒剂,请写出其反应的离子方程式:。
(5)已知28gW在氧气中燃烧,放出186.4kJ的热量,请写出此反应的热化学方程式:。