我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列判断不正确的是
| A.电池工作时,电子由铝板沿导线流向铂网 |
| B.铂电极做成网状,可增大与氧气的接触面积 |
| C.正极反应为:O2+H2O+2e-=2OH- |
| D.该电池通常只需要更换铝板就可继续使用 |
化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法正确的是
| A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
| B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH变化 |
| C.曲线图③可以表示相同pH的CH3COOH和HCl溶液分别加水稀释时溶液的pH随溶液体积变化的曲线 |
| D.曲线图④可以表示所有的固体物质溶解度随温度的变化 |
下列实验装置,其中按要求设计正确的是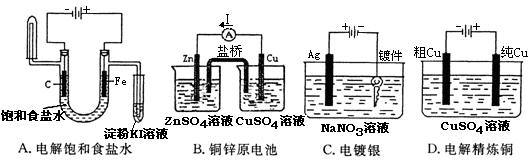
下列说法正确的是
| A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积一定是个常数 |
| B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2 |
| C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入少量盐酸,Ksp值变大 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e-+ 2H2O = 4OH- |
下列说法不正确的是
| A.在氯化钴溶液中加入一定量的浓盐酸,溶液颜色的变化是由粉红色变为蓝色 |
B.已知I3- I2 + I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2 + I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
| C.在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全 |
| D.标定NaOH溶液的基准物质可用草酸、苯甲酸、邻苯二甲酸氢钾 |