硅(Si)是太阳能电池和电脑芯片不可缺少的材料。利用石英砂(主要成分为二氧化硅)生产高纯硅的流程图如下(整个制备过程必须达到无水、无氧气)。
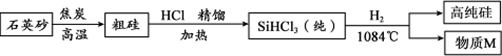
回答下列问题:
(1)该流程中无氧气的原因可能是 。
(2)以上生产高纯硅的流程中,可循环使用的物质是 。
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)人们曾经使用铅室法生产硫酸,其主要反应为:SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH=b kJ·mol-1
2NO2(g)ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH=kJ·mol-1。
SO3(g)+NO(g) ΔH=kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生如下反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是(选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是(选填序号)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3:1,则这段时间内SO2的反应速率υ(SO2)=,此反应在该温度下的平衡常数K=。
(2)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示: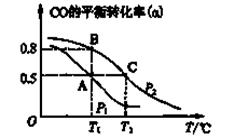
①上述合成甲醇的反应为反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为。
已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题: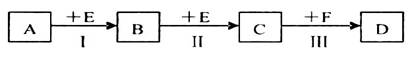
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于____________(填“离子化合物”或“共价化合物”)。
②反应I的化学方程式为____________________________________________。
③将1.92g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12L(标准状况),则反应消耗的D的物质的量为________________mol。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34g mol
mol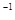 ,则:
,则:
①将铜粉与D的浓溶液反应所得溶液加热蒸干,得到的白色固体物质为_______(填化学式)。
②将少量Na2Y溶液滴加到次氯酸钠溶液中发生反应,无沉淀生成,请写出该反应的离子反应方程式_______________________。在该反应中若有74.5 g NaClO被还原,则转移电子的物质的量为_________mol。
【化学——选修5:有机化学基础】
避蚊酯(DMP)是一种塑化剂,相对分子质量为194,摄入后对人体有一定的危害,其结构可表示为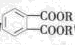 (其中R为烃基)。实验室由以下方法可得到DMP:
(其中R为烃基)。实验室由以下方法可得到DMP:
请回答:
(1)DMP的结构简式为,物质C中官能团的名称为。
(2)下列有关DMP的说法可能正确的是。(填字母标号)
A.DMP分子的核磁共振氢谱图中有六个峰
B.DMP可以发生取代、加成、氧化等反应
C.DMP在水中的溶解度不大
(3)B与乙二酸(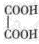 )在一定条件下可以按物质的量1:1发生反应生成高分子化合物,反应的化学方程式为。
)在一定条件下可以按物质的量1:1发生反应生成高分子化合物,反应的化学方程式为。
(4)工业上以邻二甲苯(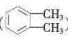 )为原料先生产苯酐
)为原料先生产苯酐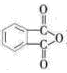 ),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为。
),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为。
(5)芳香化合物E与C互为同分异构体,若1mo1E与足量银氨溶液反应最多只能析出2mo1 Ag,则E可能的结构简式为。B也有多种同分异构体,符合以下条件的B的同分异构体有种。
①1mo1有机物可以与2mo1NaOH反应
②苯环上的一氯代物只有一种
【化学——选修3:物质结构与性质】
W、M、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为。
(2)MX3-的空间构型(用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是___________________
_______________________________________________________________________。
(4)根据等电子原理,WX分子的结构式为。
(5)1 mol WX2中含有的σ键数目为。
(6)H2X分子中X原子轨道的杂化类型为。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式。
【化学——选修2:化学与技术】
过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂。湿法生产过碳酸钠的原理和线路如图所示(BC—1,BC—2均为稳定剂):
请回答下列问题:
(1)H2O2中添加BC—Ⅰ的目的是;工业纯碱中常含有微量Fe3+,加入BC—2可与Fe3+形成配合物,这样做的原因是。
(2)过碳酸钠在高温下容易分解,所以制取时反应需控制在5℃以下进行。在反应釜中发生的主要反应为;常温结晶的过程中加入氯化钠、搅拌,作用是。
(3)下列关于过碳酸钠使用和保存的说法不正确的是。(填字母标号)
A.应与易燃或可燃物、还原剂等分开存放
B.使用时避免与眼睛、皮肤和衣服接触
C.储存于干燥洁净、不通风的仓库内
D.过碳酸钠不慎溅入眼睛应用流动清水或生理盐水冲洗,并就医
(4)过碳酸钠是一种很好的消毒剂,下列与其消毒原理相似的是。(填字母标号)
A.乙醇 B.漂粉精C.二氧化硫 D.过氧化钠
(5)工业上常以所含活性氧的质量分数 衡量过碳酸钠产品的优势,13%以上为优等品。取2g某厂家生产的过碳酸钠样品(所含杂质不参加反应)溶于水配成溶液,加入足量MnO2,反应完全后溶液质量减轻0.264g,则该样品中活性氧的质量分数为 。
衡量过碳酸钠产品的优势,13%以上为优等品。取2g某厂家生产的过碳酸钠样品(所含杂质不参加反应)溶于水配成溶液,加入足量MnO2,反应完全后溶液质量减轻0.264g,则该样品中活性氧的质量分数为 。