已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题: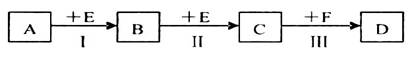
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于____________(填“离子化合物”或“共价化合物”)。
②反应I的化学方程式为____________________________________________。
③将1.92g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12L(标准状况),则反应消耗的D的物质的量为________________mol。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34g mol
mol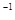 ,则:
,则:
①将铜粉与D的浓溶液反应所得溶液加热蒸干,得到的白色固体物质为_______(填化学式)。
②将少量Na2Y溶液滴加到次氯酸钠溶液中发生反应,无沉淀生成,请写出该反应的离子反应方程式_______________________。在该反应中若有74.5 g NaClO被还原,则转移电子的物质的量为_________mol。
把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g)=CO2(g)△H1<0①
途径II:先制成水煤气:C(s) +H2O(g)=CO(g)+H2(g)△H2>0②
再燃烧水煤气:2CO(g)+O2 (g)=2CO2(g)△H3<0③
2H2(g)+O2 (g)=2H2O(g)△H4<0④
请回答下列问题:
(1)途径I放出的热量( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2)△H1、△H2、△H3、△H4的数学关系式是。
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为。
(4)煤炭作为燃料采用途径II的优点有。
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)在容量瓶的使用方法中,下列操作不正确的是____________(不定项选择)
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。 |
(3)甲、乙两同学欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①每位同学各需要量取________mL上述浓盐酸进行配制。(保留小数点后一位)
②在配制过程中,甲同学存在以下不正确操作,对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
③乙同学转移溶液时操作如图所示,其中存在的错误是____________________________________________。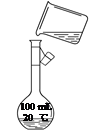
(1)在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,_________是氧化剂, _______是还原剂,HCl表现的性质是_______和________,1mol K2Cr2O7反应转移电子的物质的量是_________。
(2)下列物质中①食盐水②NaOH ③Cu ④HCl气体⑤空气 ⑥酒精 ⑦CO2⑧KNO3属于电解质的是(填序号,下同);属于非电解质的是。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究过氧化氢的性质。
请填写下列空白:
(1)移取10.00 mL密度为ρg·mL-1的过氧化氢溶液至250 mL________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。 MnO4-+
MnO4-+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ O2+
O2+
(3)滴定时,将高锰酸钾标准溶液注入____________(填“酸式”或“碱式”)滴定管中。
如何判断滴定到达终点:
。
(4)如图表示25 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)________。
| A.是a mL | B.是(25-a)mL | C.一定大于a mL | D.一定大于(25-a)mL |
(5)重复滴定三次,平均耗用c mol·L-1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_________________。
(6)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果________(填“偏高”或“偏低”或“不变”)。
Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1回答下列问题。
CH3OH(g)+H2O(g) ΔH1回答下列问题。
(1)已知:2H2(g)+O2(g)=2H2O(g) ΔH2
则反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH= (用含ΔH1、ΔH2表示)
(2)若反应温度升高,CO2的转化率 (填“增大”“减小”或“不变”)。
(3)写出在酸性环境中,甲醇燃料电池中的正极反应方程式
Ⅱ:生产甲醇的原料H2可用如下方法制得:CH4(g) + H2O(g)  CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
(4)反应进行到4分钟到达平衡。请计算从反应开始到刚刚平衡,平均反应速率v(H2)为 ;并求此反应在此温度下的平衡常数(在答题卡对应的方框内写出计算过程)。
(5)在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡(此时CO的浓度约为0.25 mol·L—1 ),请在图中画出第5分钟后H2浓度的变化曲线。