被称之为“软电池”的纸质电池,采用薄层纸片作为传导体,电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH),避免了传统电池所带来的污染问题,因而废旧的纸质电池可作为一般的废弃物加以处理.下列说法错误的是
| A.该电池反应中锌元素化合价升高 |
| B.该电池反应中二氧化锰作催化剂 |
| C.工作原理是将化学能转化为电能 |
| D.开发利用该电池可以减少对环境的污染 |
下列关于浓HNO3与浓H2SO4的叙述正确的是
| A.常温下都不可用铁制容器贮存 | B.常温下都能与铜较快反应 |
| C.露置于空气中,溶液质量均减轻 | D.露置于空气中,溶液浓度均降低 |
在10℃时某化学反应速率为0.1mol/(L·s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol/(L·s),则该反应需在什么温度下进行()
| A.30℃ | B.40℃ | C.50℃ | D.60℃ |
实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)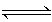 2SO3(g)ΔH ="-196.64" kJ/mol,当放出314.624 kJ热量时,SO2的转化率为()
2SO3(g)ΔH ="-196.64" kJ/mol,当放出314.624 kJ热量时,SO2的转化率为()
| A.40% | B.50% | C.80% | D.90% |
管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:
2H2(g)+O2(g)==2H2O(l)ΔH ="-571.6" kJ/mol
2CO(g)+O2(g)==2CO2(g)ΔH ="-566" kJ/mol
CH4(g)+2O2(g)==CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的燃气,理论上所获得的热值后者大约是前者的多少倍()
| A.0.8 | B.1.3 | C.1.6 | D.3.1 |
已知:
(1)H2(g)+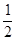 O2(g)==H2O(g)ΔH1 =a kJ·mol-1
O2(g)==H2O(g)ΔH1 =a kJ·mol-1
(2)2H2(g)+O2(g)==2H2O(g)ΔH2 =b kJ·mol-1
(3)H2(g)+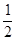 O2(g)==H2O(l)ΔH3 =c kJ·mol-1
O2(g)==H2O(l)ΔH3 =c kJ·mol-1
(4)2H2(g)+O2(g)==2H2O(l)ΔH4 =d kJ·mol-1
下列关系式中正确的是()
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |