在实验室小金分别用甲盐的晶体配置了溶质质量分数为5%的A溶液和30%的B溶液,但忘了贴标签,请你运用两种不同的科学原理,分别设计两个简单实验来判别这两瓶溶液。请写出简要的实验方案和明确的判别依据。有下列仪器、物品供选择:量筒、天平、
小烧杯、酒精灯、三脚架、石棉网、漏斗、玻璃棒、滤纸、温度计、新鲜罗卜、甲盐的晶体。
(实验室的室温为30℃,30℃甲盐的溶解度为50g)
方案1:
判别依据:
方案2:
判别依据:
在进行某实验探究过程中,一些学生发现等质量的铜片分别与等体积(均过量)的浓硝酸和稀硝酸反应,所得溶液前者为绿色,后者为蓝色。
针对这种现象,学生们进行了讨论后,出现了以下两种观点:
一种认为,这可能是Cu2+浓度的差异引起的。你同意这种看法吗?(填“同意”或“不同意”),原因是。
另一种认为,呈“绿色”是Cu2+与NO2混合的结果。请你设计出一个实验方案证明之,你设计的实验方案是
已知0.3mol Cu与足量的稀硝酸反应,则被还原的HNO3的物质的量是mol。
某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题:
(1)实验室制备氨气的化学方程式为;干燥氨气常用的干燥剂是。
(2)收集氨气时,请你选择氨气的进气口(填“a”或“b”)。
(3)①、若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是。
②、若装置B中的烧瓶充满干燥气体,烧杯中盛有液体,下列组合中不可能形成喷泉的是
A、HCl和H2O B、H2和H2O C、CO2和NaOH
(4)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式。
)实验室制备溴苯可用如图所示的装置,填写下列空白:
(1)关闭F夹,打开C夹,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入少量铁屑,塞住
A口,反应一段时间制的溴苯。溴苯是一种密度比水(填”小”或”大”)的无色液体,在实
验中因为而显褐色。则三口烧瓶中发生反应的化学方程式为_____和___。
(2)D、E试管内出现的现象为_____________________________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C,可以看到的现象是
____________________________________。
(4)三口烧瓶中的溴苯经过下列步骤分离提纯:
①向三口烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为_____________,要进一步提纯,下列操
作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
两位同学设计了下述两个方案, 并都认为如果观察到的现象和自己所设计的方案一致,即可确定无色气体中一定含有SO2和CO2气体。

请你评价上述两个方案是否严密,并说明理由。
方案甲:_________,______________________
方案乙:_________,_______________________ 。
实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
| NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
Na2SO4 |
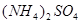 |
CaCl2 |
MgCl2 |
CaSO4 |
| 36.3 |
27.0 |
11.1 |
41.4 |
40.8 |
78 |
51.7 |
26.2 |
0.165 |
制备纯碱的步骤如下:
① 配制50 mL约25%的粗食盐水溶液(密度近似为1 g/cm3)。
② 精制食盐水(粗食盐中含有少量Ca2+、Mg2+、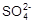 等杂质)用盐酸将滤液的pH值调至7。
等杂质)用盐酸将滤液的pH值调至7。
③ 加热食盐水,将溶液温度控制在30 ─ 35℃。
④ 在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、 搅拌半小时。
⑤ 静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥ 将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是______________________;
(2)步骤②中,SO42-是否需要除去?_________,理由是________________
(3)步骤④中所有操作的共同目的是_____________;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是____________,在通常情况下,检验这种阳离子的方法_______________________。