由原子序数依次增大的五种短周期元素A、B、C、D、E,已知A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素最高价氧化物的水化物与其氢化物反应生成一种盐;A、B、C、E四种元素分别都能与D元素形成原子个数比不相同的多种常见化合物,回答下列问题:
(1)B在周期表中的位置是 ,C元素的单质的电子式 。
(2)写出同时含A、B、C、D四种元素的一种盐的化学式 。
(3)E与D形成的一种化合物与BD2发生氧化还原反应,该反应的化学方程式为 。
(4)用A和D两元素组成的单质可以制成一种燃料电池,电池中装有浓KOH溶液。用多孔的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过的隔膜,在一极通入A的单质,另一极通入D的单质。则该电池正极的电极反应式为 。
(5)化合物C2A4和C2D4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。已知1mol C2A4和C2D4完全反应生成两种气体时放出热量516.8KJ,则该反应的热化学方程式为 。
某学生利用下面实验装置探究盐桥式原电池的工作原理。按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:_______________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为_____;(用“NA”表示)
(4)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |
(5)实验室用惰性电极电解200ml的硝酸银溶液一段时间后,撤去电源,若加入23.2g氧化银恰好使电解液恢复到原来状态,则电解过程中转移电子数为 mol;若加入25.0g氢氧化银恰好使电解液恢复到原来状态,则原硝酸银溶液的物质的量浓度为 mol·L-1。
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等。
(1)下列ΔH表示物质标准燃烧热的是________;表示中和反应反应热的是________。(填“ΔH1”、“ΔH2”、“ΔH3”等)
A.2H2(g)+O2(g)===2H2O(l) ΔH1
B.C(s)+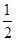 O2(g)===CO(g)ΔH2=-Q1kJ·mol-1
O2(g)===CO(g)ΔH2=-Q1kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH3
D.C(s)+O2(g)===CO2(g)ΔH4=-Q2kJ·mol-1
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
(2)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6 kJ的热量,写出该反应的热化学方程式:_________________。
(3)根据题(1)中B、D判断1 molCO(g)完全燃烧的ΔH= 。
(4)反应E的ΔH6可以用如图所示的装置进行测量。实验中直接测定的数据是 ;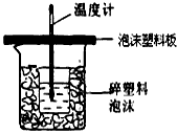
从实验装置上看,图中尚缺少的一种玻璃用品是_____________;大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值________(填“偏大”“偏小”或“无影响”)。
(1)反应N2O4(g) 2NO2(g);DH>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是 。
2NO2(g);DH>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是 。
(2)在298K时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
20~40 s内用N2O4表示的平均反应速率为________mol·L-1·s-1;298K时该反应的平衡转化率=________;反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”、“变深”或“不变”);
(3)298K时,反应2NO2(g) N2O4(g);DH<0达到平衡后,根据下列图像判断引起平衡移动的因素及平衡移动的的方向:
N2O4(g);DH<0达到平衡后,根据下列图像判断引起平衡移动的因素及平衡移动的的方向:
图(2)平衡将向_______方向移动;图(3)引起平衡移动的因素是_____________,图(4)引起平衡移动的因素是______________。
现有浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)属于弱电解质溶液的是____ __,导电能力最弱的是____ __。
(2)三种溶液中氢离子浓度最大的是____ ;加水稀释100倍,氢离子浓度大于0.002mol·L-1的是____ __。
(3)测得上述醋酸溶液中氢离子浓度为0.004mol·L-1,则醋酸的电离度为 ,该温度下醋酸的电力平衡常数K= 。
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4 + 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为: 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是 。
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。