(1)反应N2O4(g) 2NO2(g);DH>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是 。
2NO2(g);DH>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是 。
(2)在298K时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
20~40 s内用N2O4表示的平均反应速率为________mol·L-1·s-1;298K时该反应的平衡转化率=________;反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”、“变深”或“不变”);
(3)298K时,反应2NO2(g) N2O4(g);DH<0达到平衡后,根据下列图像判断引起平衡移动的因素及平衡移动的的方向:
N2O4(g);DH<0达到平衡后,根据下列图像判断引起平衡移动的因素及平衡移动的的方向:

图(2)平衡将向_______方向移动;图(3)引起平衡移动的因素是_____________,图(4)引起平衡移动的因素是______________。
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为__________________________
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_________>_________>_________>_________。
(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式_________________________
原子序数之和为16的三种短周期元素的单质X、Y、
Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化。已知B分子组成中Z原子个数比C分子中少一个。请回答下列问题: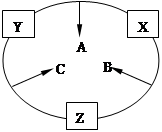
(1)元素X的原子结构示意图
(2)C与X在一定条件下生成化合物A的化学方程式
(3)常温下,C的水溶液能够使红色石蕊试纸变蓝,请用离子方程式表示变蓝的原因
(4)写出A与C反应生成Y和B的化学方程式
(5)加热条件下,C通过装有含X的黑色粉末的硬质玻璃管,黑色粉末变成紫红色,该黑色粉末的化学式 ;发生反应化学方程式为 。
在25 ℃,101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________L,V(H2)=________L。若剩余气体的体积为a L。则原CO和H2的混合气体中V(CO)∶V(H2)=________。若剩余气体的体积为a L,则a的取值范围是 。
如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH3 0.4 mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量差为17.3g。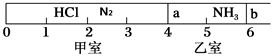
(1)甲室中气体的质量为____ ____。
(2)甲室中HCl、N2的物质的量之比为____ __。
(3)将隔板a去掉,当HCl与NH3充分反应生成NH4Cl固体后(仅发生此反应),隔板b将位于刻度“________”处(填数字,不考虑固体物质产生的压强),此时体系的平均摩尔质量 。
经实验测定,在4 ℃时,水的密度最大,为1 g/mL,请计算一下,4 ℃时1 L水中含有的水分子数为 ,每个水分子的质量为 。