海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。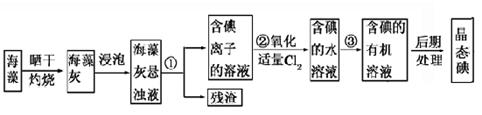
(1)指出提取碘的过程中有关的实验操作名称:①________________,③_______________。
写出实验②中有关反应的离子方程式:_________________________________。
(2)提取碘的过程中,可供选择的有关溶剂是________________________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,乙二醇 |
(3)为了使海藻灰中碘离子转化为碘的有机溶液,实验室准备了烧杯、玻璃棒、锥形瓶、酒精灯、导管、圆底烧瓶,石棉网以及必要的夹持仪器、物品。如上流程图所示,还缺少的玻璃仪器是_________________________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图实验装置中的错误之处: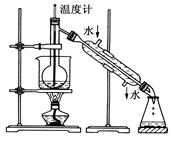
①______________________;
②__________________________;
③________________________。
(5)进行上述蒸馏法操作时,使用水浴的原因是_______________;最后,晶态碘在__________________里聚集。
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
I.铁含量的测定
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010 mol·L—1KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO4—被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液19.98 mL
请回答下列问题:
(1)步骤一中配制三草酸合铁酸钾溶液使用到的玻璃仪器包括:烧杯、玻璃棒、
(2)步骤二中加入锌粉至黄色刚好消失,目的是___________________________。
(3)写出步骤三中发生反应的离子方程式 _________________。
(4)根据实验数据,测得该晶体中铁元素的质量分数为__________________________________。
(5)若步骤二中加入的KMnO4的溶液的量不足,则测得的铁含量(选填填“偏低”“偏高”或“不变”)
II.结晶水的测定
(6)采用热重分析仪测定三革酸合铁酸钾晶体K3[Fe(C2O4)3]·xH2O在100℃时的失重率为a%,则晶体化学式中结晶水的个数x的计算式为_________________(已知:三草酸合铁酸钾的摩尔质量M(K3[Fe(C2O4)3]) =510g/mol)
氯气用途广泛,某中学化学兴趣小组设计了制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用药品为:漂白粉固体和浓盐酸,相关的化学反应方程式为:。
(2)仔细观察装置B,该装置B的作用为。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入:。(选填字母序号)
| a |
b |
c |
d |
|
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是。但该现象不能说明溴的非金属性强于碘,原因是。
(5)氯气可用于自来水消毒,现已逐步被二氧化氯替代。ClO2不稳定,可与NaOH溶液、H2O2反应,转化为比较稳定的亚氯酸钠。该反应的化学方程式为。
用ClO2处理的自来水中会残留ClO2,可用FeCl2将其还原。现用V L(已换算为标准状况)ClO2处理一定量自来水,再加入a mol FeCl2可将残留的ClO2恰好除去。则该自来水中残留ClO2的物质的质量为g。
(6)某同学自己制备了漂白粉,他将制备产物溶于水,再加入酚酞后显红色,一会又变成无色,该同学据此判断,自己制备的漂白粉成分为Ca(OH)2、Ca(ClO)2。兴趣小组认为该同学的判断不正确,原因是。
有二氧化碳与一氧化碳的混合气体共10.8 g,其物质的量为0.3 mol。求:
(1)混合气体中二氧化碳与一氧化碳的物质的量各为多少?
(2)混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是什么?其质量为多少?所含分子数为多少?
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用如图所示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1的盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去。)
填写下列空白:
(1)实验进行时试管A中应加入的试剂是_________________;烧瓶B的作用是____________;烧瓶C的作用是_______________
(2)实验时,长颈漏斗H中应加入_____________________U型管G的作用是____________
(3)装置I中,在实验时需要加热的仪器是(填该仪器对应的字母)_____________ ;
当反应转移了4mol电子时,试管D中收集到的气体在标准状况下的体积为_____________。
(4)写出试管A中发生反应的化学方程式:________________________
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程 中放出的热量可计算中和热。回答下列问题: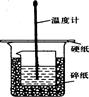
(1)烧杯间填满碎纸条的作用是 。
(2)从实验装置上看,图中缺少的仪器是 。
(3)实验中若用70mL0.50mol·L-1盐酸跟70mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”).
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会(填“偏大”“偏小”或“无影响”)。