Ⅰ:有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上可通过下列合成方法制得:
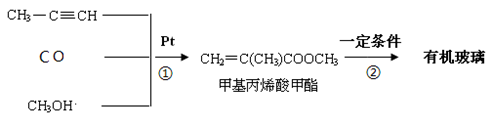
请回答:
(1)反应 ① 的原子利用率是 。
(2)反应 ② 的化学方程式是 。
(3)有机玻璃分子中的链节是 。
Ⅱ:甲基丙烯酸甲酯旧法合成的反应是:
①(CH3)2C=O + HCN (CH3)2C(OH)CN
(CH3)2C(OH)CN
②(CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C(CH3)COOCH3 + NH4HSO4
CH2=C(CH3)COOCH3 + NH4HSO4
(1)该方法的缺点是 (填字母)
A.反应的原料利用率低 B.原料中有有毒物质
C.对设备腐蚀性较大 D.生产成本高
(2)甲基丙烯酸甲酯可进行的反应有 (填字母)
A.加成反应 B.氧化反应 C.取代反应 D.酯化反应
Ⅲ:将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有浓硫酸的洗气瓶和碱石灰的干燥管,测得洗气瓶的质量增加了2.16 g,干燥管的质量增加了9.24 g,已知该有机物的相对分子质量为108。
(1)该有机物的分子式 。
(2)已知该物质中含有苯环,且1mol该物质与金属钠反应后生产标准状况下氢气0.5mol,满足该条件的同分异构有 种,写出其中苯环上一溴取代同分异构种类最少的该有机物的结构简式 。
【化学—选修5有机化学基础】某芳香烃A是有机合成中非常重要的原料,通过质谱法测得其最大质荷比为118;其核磁共振氢谱中有5个峰,峰面积之比为1:2:2:2:3;其苯环上只有一个取代基。以下是以A为原料合成高分子化合物F、I的路线图,试回答下列问题: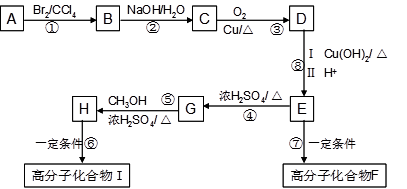
(1)A的结构简式为 。
(2)D中的官能团名称是 。
(3)I的结构简式为 。
(4)上述反应中属于取代反应的是 。
(5)反应⑥、⑦生成的高分子化合物的反应原理是否相同 。
(6)写出下列反应的化学方程式:
反应⑤ ;反应⑦ 。
(7)符合以下条件的D的同分异构体有 种(不考虑立体异构)。
| A.苯环上有两个取代基 | B.苯环上的一氯代物有两种 |
| C.加入三氯化铁溶液不显色 | D.能发生银镜反应 |
【化学—选修3物质结构与性质】前四周期原子序数依次增大的六种元素M、A、B、C、D、E中,M、A的最高化合物与最低化合价的绝对值相等,A形成的化合物种类最多,A、B属于同一短周期元素且相邻, C、D、E是位于同一周期的金属元素,基态C原子的价电子层中未成对电子为1个,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),其原子结构示意图是______。
(2)M与B元素形成的化合物空间构型是_____,在实验室制取该物质的方法是 (用化学反应方程式表示),收集方法是_______;
(3)E的价层电子排布图为 ,未成对的电子数是______;很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。
、④HCHO。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
(4)金属C晶体的晶胞结构如图。C晶体晶胞中金属原子的配位数之比为 。在一个晶胞中含有C原子是_____个。氧化镍(NiO )是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm列式表示其比表面积 m2/g。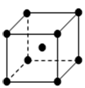
【化学—选修2化学与技术】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备硫酸、聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
请回答下列问题:
(1)过程①中,加快反应速率的方法有 。FeS和O2、H2SO4反应的化学方程式是____________。
(2)过程②中产生的气体可用于氧化产生硫酸,为使SO2尽快、尽多的转化为SO3,可采取的措施是_____(填字母)
A.高温、高压 B.适当温度、催化剂
C.通入过量的氧气 D.低温、低压
产生的尾气会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
A.浓H2SO4B.蒸馏水 C.NaOH溶液D.浓硝酸
(3)过程③中,需要加入的物质名称是_______。反应的离子方程式是________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用天平称取样品5.35g;②将样品溶于足量硝酸酸化后,再加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为6.99g。若该聚铁主要成分为[Fe(OH) SO4]n,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
CO的应用和治理问题属于当今社会的热点问题。
(1)在实验室中以甲酸和浓硫酸混合加热制取CO,该反应的方程式是:__________;
(2)HCOOH的酸性略强于醋酸,是实验室制取CO的主要试剂,在0.1mol/L HCOOH溶液中,溶质分子和各种离子浓度由大到小的顺序为 。常温下,将0.2mol/L HCOOH和0.1mol/LNaOH溶液等体积混合,所得溶液的pH<7,说明HCOOH的电离程度________HCOONa的水解程度(填“大于”或“小于”)。该溶液中c(HCOOH)-c(OH-) +c(H+)=______mol/L
(3)已知:硫的燃烧热为296 kJ/mol;一氧化碳燃烧热为283 kJ/mol。为防止镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。该反应的热化学方程式为 。
(4)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) 
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,如图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,如图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题: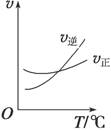
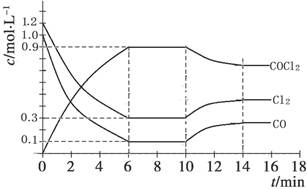
①0~6 min内,反应的平均速率v(COCl2)= ;
②若保持温度不变,在第8 min 加入体系中的三种物质各3mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不移动”);
③在恒温恒压条件下,若将初始投料浓度变为c(Cl2)=amol/L、c(CO)=bmol/L、c(COCl2)=cmol/L,(a、b、c都大于0)则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同,则a、b、c三种物质的关系是________
④随温度升高,该反应平衡常数变化的趋势是 。(填“增大”、“减小”或“不变”)
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一。
| X |
|||
| Z |
W |
Y |
(1)写出W的离子结构示意图: 。其单质与最高价氧化物对应的水化物反应的化学方程式是_________。
(2)已知:①X(s) + O2(g) =XO2(g)ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g)ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g)ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。XH4分子空间构型是 ,其与Y的单质在光照时发生反应可以产生常用的有机溶剂,则该反应的类型是________。
(3)①XH4可与氧气构成燃料电池,若电解质溶液为KOH,则该燃料电池的负极电极反应式是______,电池的总反应方程式是____________。
②若以该电池产生的电能为电源,以石墨为电极电解500ml某浓度的CuSO4溶液,当电解完全,共产生Cu的质量是96g, CuSO4溶液溶液的浓度是_______。若甲烷燃料电池的能量利用率是75%,则会消耗标准状况下的甲烷的体积是_________。
(4)将X的最高价氧化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。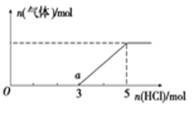
①O点溶液中所含溶质的化学式为____________。
②该溶液中溶质的物质的量是_______________。