美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200oC左右供电。电池总反应为:C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是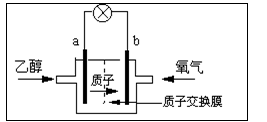
| A.a极为电池的正极 |
| B.电池工作时电流由a极沿导线经灯泡再到b极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e-=2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
下列试剂不能使Fe2+转化为Fe3+的是
①氯气②氢氧化钠溶液③高锰酸钾溶液④稀硝酸⑤磷酸溶液⑥硫化钠溶液
| A.①②③ | B.①③④ | C.④⑤⑥ | D.②⑤⑥ |
将表面已完全钝化的铝条插入下列溶液中,不会发生反应的是
| A.稀硝酸 | B.稀盐酸 | C.硝酸铜 | D.氢氧化钠 |
下列不能使有色布条褪色的物质是
| A.氯水 | B.次氯酸钠溶液 | C.漂白粉溶液 | D.氯化钙溶液 |
在下列溶液中通入CO2至过量,原溶液一直保持澄清的是
| A.硅酸钠溶液 | B.氯化钡溶液 | C.石灰水 | D.漂白粉溶液 |
硅及其化合物在材料领域中应用广泛。下列叙述中不正确的是
| A.硅单质可用来制造太阳能电池 |
| B.硅单质是制造玻璃的主要原料 |
| C.石英(SiO2)可用来制作工艺品 |
| D.二氧化硅是制造光导纤维的材料 |